某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(OH-) = ___________。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = ___________。
硅和硅的化合物既是传统的无机非金属材料又是重要的现在新型材料。
(1)陶瓷、玻璃、水泥的组成中的共同成分是__________盐。
(2)2009年,华裔科学家高锟以研究传播力纤维光信号传输的骄傲成绩获得诺贝尔物理奖,制造光导纤维的原材料是______________。
新制氯水中含有Cl2、H2O、HClO、H+、Cl-等粒子,根据下列性质选择恰当的粒子进行填空。
①使新制绿水呈现浅黄绿色的物质是___________________.
②能起杀菌消毒作用,光照易分解的弱酸是______________.
③能与硝酸银作用生成白色沉淀的离子是_______________.
(10分)下表列出了①~⑥六种元素在元素周期表中的位置。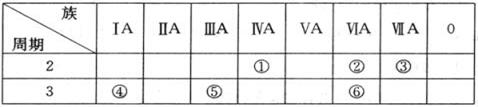
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是____(填写元素符号);
(2)元素①③⑥的氢化物的化学式分别是__ __;___ _;__ _ _.
(3)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是______ ____________。
(6分)下列三种有机物中:
A.淀粉B.CH2=CH2C.CH3COOH
(1)水溶液显酸性且是食醋的主要成分是(填编号,下同)。
(2)可用于合成聚乙烯塑料的是。
(3)通常用于检验碘单质的是。
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
请回答下列问题:
(1)A的化学名称是_______;
(2)B和A反应生成C的化学方程式为__________,
该反应的类型为_________;
(3)D的结构简式为___________;
(4)D的同分异构体的结构简式为___________。