下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题: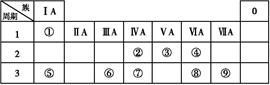
(1)已知由①、③、④三种元素组成的某种常见化合物的水溶液呈酸性,则符合该条件的化合物的化学式可能为 (至少写两种)。
(2)由表中①、④两种元素按原子个数比为1∶1构成的化合物的稀溶液易被催化分解,通常使用的催化剂为 (填序号)。
a、MnO2 b、FeCl3 c、Na2SO3 d、KMnO4
(3)下图中A~F是由部分上表中元素组成的单质或化合物,其中A、B、C为单质,转化关系如下: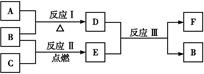
Ⅰ.若B为黄色固体,A为原子半径最小的原子组成的单质。
①F的电子式为 。
②实验测得起始参加反应的B和最后生成的B质量相等,则起始参加反应的A和C的物质的量之比是 。
Ⅱ.若D为淡黄色固体,焰色反应为黄色,组成C的元素的原子最外层电子数是内层电子数的2倍。
①下列关于D的说法正确的是 (填字母)。
a.能与水发生化合反应
b.既有氧化性,又有还原性
c.既含离子键,又含非极性共价键
d.是一种碱性氧化物
②用惰性电极将F的饱和溶液进行电解,则阳极反应式是 。
现有25 ℃时,0.1 mol/L的氨水。请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(填“增大”、“减小”或“不变”)。
________。(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:___________________;所得溶液的pH________7(填“<”、“>”或“=”),用离子方程式表示其原因_______________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH)=a mol/L,则c(SO)=____________。
(4)若向氨水中加入pH=1的硫酸溶液,且氨水与硫酸溶液的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是___________________________________。
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min);
(2)氢气的转化率= _____;
(3)该反应的平衡常数为 _____(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 ___。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1mol H2 |
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1 c2的关系(填“>”、“<”或“=”)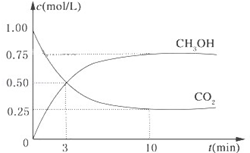
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l)ΔH1=-571.8kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)ΔH2=-192.9kJ/mol
(1)甲醇蒸气完全燃烧的热化学方程式为_____________________________。
(2)反应②中的能量变化如图所示,则ΔH2=_________________________。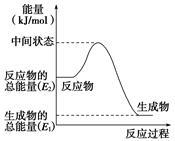
(3)H2(g)的燃烧热为____________________。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1mol NH3时可放出46.2kJ的热量。N-H键的键能是_________
(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ。写出该反应的热化学方程式:① 。
已知常温下NO与O2反应生成1molNO2的焓变为-57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为-46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式② 。
(3)某温度下纯水中的c(H+) = 2×10-7mol/L,则此时c(OH-) =________mol/L,该纯水的pH_______(填“>7”、“<7”、“=7”)。若温度不变,滴入稀硫酸使c(H+) = 5×10-6mol/L,则c(OH-) =________mol/.
(4)纳米MgO可用于尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 |
温度/K |
反应时间/h |
反应物物质的量配比 |
实验目的 |
| ① |
378 |
3 |
3:1 |
实验②和④探究a 实验②和b 探究反应时间对产率的影响 |
| ② |
378 |
4 |
4:1 |
|
| ③ |
378 |
3 |
c |
|
| ④ |
398 |
4 |
4:1 |
有①CH3COOH;②HCl;③H2SO4三种酸。
(1)CH3COOH溶液中,其电离平衡常数表达式为K = _________________
(2)0.1 mol/L的三种酸溶液,c(H+)由大到小的排列顺序是 (填序号)。
(3)体积相同、c(H+)相同的三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是 (填序号)。
(4)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为___________;
(5)已知,H+(aq) + OH-(aq) ="=" H2O(l)ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57kJ的热量,则醋酸溶液中,醋酸电离的热化学方程式为____________。