(1)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为 。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1 mol·L-1硫酸铝溶液;②0.1 mol·L-1氯化钡溶液;③蒸馏水;④0.1 mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是 (用序号填写)。
(3)常温下,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合,当溶液中c(N )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。回答下列问题: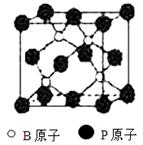
(1)写出基态磷原子的外围电子轨道表示式
(2)磷化硼的晶体类型是 ,B原子的杂化方式是 。
(3)电负性:N B (填“>”、“<”)
(4)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(5)BBr3分子中,B原子采取sp2杂化,则BBr3属于 (填“极性”或“非极性”)分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 。
(1)Cu位于元素周期表第I B族,Cu2+的核外电子排布式为。
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:
下列说法正确的是(填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
(4)Cu2O的熔点比Cu2S的(填“高”或“低”),请解释原因。
(5)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于晶体;基态Ni原子的电子占有种能量不同的原子轨道
(6)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
①CH2=CH2、②CH≡CH、③ 、④
、④ 等,其中分子中C原子为SP2杂化的
等,其中分子中C原子为SP2杂化的
有(填物质序号),预测HCHO分子的立体结构为形。
(1)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
| 代号 |
物质 |
结构简式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
| A |
对—硝基苯酚 |
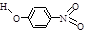 |
1.7 |
114 |
295 |
| B |
邻—硝基苯酚 |
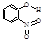 |
0.2 |
45 |
100 |
(2)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子。甲和乙的主要物理性质比较如下:
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| 甲 |
187 |
202 |
2.6 |
| 乙 |
272 |
423 |
以任意比互溶 |
①1 mol乙分子含有个σ键;
②丙分子的中心原子采取杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是
(结合具体物质解释)。
一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。。
(1)该电池反应的总离子方程式为____________________________________________;
(2)甲醇在_________极发生反应(填正或负),电池在放电过程中溶液的pH将__________(填降低或上升、不变);
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①放电时固体电解质里的O2-离子的移动方向是向____________极移动(填正或负)。
②电池的正极反应式为____________________________________________。
下表列出了几种键的键能:
| 化学键 |
H—H |
Cl—Cl |
H—Cl |
| 键能/kJ·mol-1 |
436 |
243 |
431 |
请根据以上信息写出氢气在氯气燃烧生成氯化氢气体的热化学方程式:
。