一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。。
(1)该电池反应的总离子方程式为____________________________________________;
(2)甲醇在_________极发生反应(填正或负),电池在放电过程中溶液的pH将__________(填降低或上升、不变);
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①放电时固体电解质里的O2-离子的移动方向是向____________极移动(填正或负)。
②电池的正极反应式为____________________________________________ 。
I .用序号回答下列各题:
①  和
和 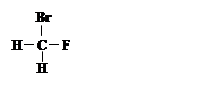
②1H—、2H、3H +、D2 ③淀粉和纤维素
④  和
和
⑤16O2、18O3⑥235U、238U
其中互为同位素的是。
互为同素异形体的是。
互为同分异构体的是。
是同一种化合物的是。
II. 请选择合适的试剂检验某物质中是否含括号内物质:
| 序号 |
原物质(需检验物质) |
试剂 |
| ① |
CO2(SO2) |
|
| ② |
乙醇(水) |
|
| ③ |
直馏汽油( 裂化汽油) |
Ⅲ.某元素R气态氢化物化学式为HnR。若最高价氧化物对应水化物分子中有b个氧原子,则其最高价氧化物对应水化物化学式通常表达为。(含n和b)
[化学———有机化学基础]以下几种物质是常用香精的主要成分
请回答下列问题:
(1)百里香酚和苏合香醇都能发生的有机反应类型有(填序号)。
①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤缩聚反应
(2)写出风信子醛与新制氢氧化铜反应的化学方程式:
(3)已知醛在一定条件下可以两分子加成: 
草醛是重要的合成香料,它具有独特的新鲜水果的清香。由枯茗醛合成兔耳草醛的路
线如下: 
①写出A的结构简式;
②设计实验方案检验有机物B中无氧官能团的方法;
③写出C→兔耳草醛的化学方程式;
④符合下列条件的A的同分异构体有种。
ⅰ.苯环上有两个取代基,其中一个取代基为—CH(CH3)2
ⅱ.能发生水解反应水解产物之一能与FeCl3溶液发生显色反应。
[化学———物质结构与性质]
已知X,Y,Z,Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为,X、Y、Z中第一电离能最大的是。
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
该分子中Y原子的杂化方式是。
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法
正确的是(填正确答案编号)。
| A.该晶体属于分子晶体 | B.此晶体的硬度比金刚石还大 |
| C.晶体的化学式是X3Y4 | D.晶体熔化时破坏共价键 |
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为 。
(5)R的基态原子的电子排布式为,R与Z形成的某离子晶体的晶胞结构如图,则该晶体的化学式为,该晶体的密度为a g·cm-3,则晶胞的体积是 。
。
【化学———化学与技术】
锶( )元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
和 同属于第ⅡA族。
同属于第ⅡA族。
(1)碱性:Sr(OH)2Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH 
①Ⅰ中,反应的化学方程式是。
②Ⅱ中,能与盐酸反应溶解的物质有。
③Ⅳ的目的是。
④该工艺流程中NH4HCO3含有的化学键是。
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因。
(1)汽车尾气净化的主要原理为; , 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
, 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是。
| A.在单位时间内生成1molCO2的同时消耗了lmolCO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |
②在t2时刻,将容器的容积迅速扩大到原来的2倍, 在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4时刻正反应速率随时间的变化曲线: 
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为:
①该反应在下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为。(已知: ;
; 。
。 ;
;  。)
。)
(3)已知反应: ,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: 
①实验1条件下平衡常数K=(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是。
③该反应的 0(填“<”或“>”);
0(填“<”或“>”);