T ℃、2 L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体)。回答下列问题。
(1)写出该反应的化学方程式: 。
(2)反应开始至3 min时,用D表示的平均反应速率为 mol·L-1·min-1。
(3)T ℃时,该反应的化学平衡常数K= 。
(4)第6 min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 。
(5)另有一个2 L的密闭容器,T ℃、某一时刻,容器中各物质的物质的量如表所示。
| 物质 |
A |
B |
D |
E |
| 物质的量(mol) |
0.8 |
1.0 |
0.4 |
0.2 |
此时v(正) v(逆)(填“大于”、“等于”或“小于”)。
“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有(填字母)。
a.采用节能技术,减少化石燃料的用量 b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g)△Hl="+1411.0" kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g)△H2="+1366.8" kJ/mol
则由乙烯水化制乙醇的热化学方程式是。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率(填“增大”“减小”或“不变”)。
②该反应的正反应为(填“吸”或“放”)热反应。
氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为,
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如下图,请结合化学用语从化学平衡的角度解释: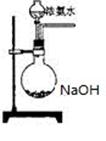
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。
首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。
已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.
写出氧化吸收法除去氮氧化物的化学方程式___________________
“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有(填字母)。
a.采用节能技术,减少化石燃料的用量 b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g)△Hl="+1411.0" kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g)△H2="+1366.8" kJ/mol
则由乙烯水化制乙醇的热化学方程式是。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。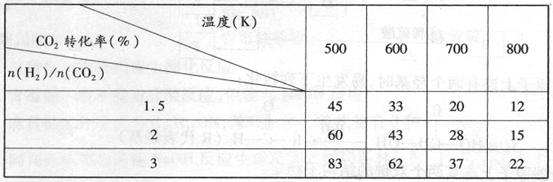
根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率(填“增大”“减小”或“不变”)。
②该反应的正反应为(填“吸”或“放”)热反应。
氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为,
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如下图,请结合化学用语从化学平衡的角度解释: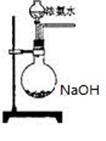
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。
首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。
已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.
写出氧化吸收法除去氮氧化物的化学方程式___________________
以有机物A为原料合成重要精细化工中间体TMBA(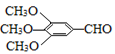 )和抗癫痫药物H(
)和抗癫痫药物H(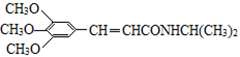 )的路线如下(部分反应略去条件和试剂):
)的路线如下(部分反应略去条件和试剂): 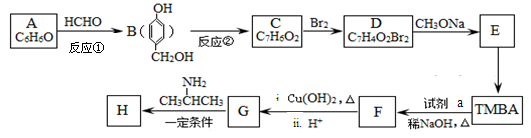
已知:I. RONa + R’X → ROR’+ NaX;
II. RCHO + R’CH2CHO 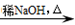
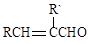 + H2O(R、R’表示烃基或氢)
+ H2O(R、R’表示烃基或氢)
(1)A的名称是;C能发生银镜反应,则C分子中含氧官能团的名称是。
(2)①和②的反应类型分别是、。
(3)E的结构简式是,
(4)D的同分异构体有多种,其中属于芳香族酯类化合物的共有种。
(5)F与新制Cu(OH)2悬浊液发生反应的化学方程式是。
(6)已知酰胺键(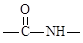 )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式。
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式。