化合物F是一种重要的有机合成中间体,它的合成路线如下:
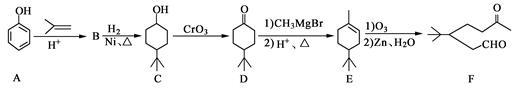
(1)化合物F中含氧官能团的名称是 和 ,由B生成C的化学反应类型是 。
(2)写出化合物C与乙酸反应生成酯的化学方程式: 。
(3)写出化合物B的结构简式: 。
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式: (任写一种)。
(5)请根据已有知识并结合相关信息,写出以苯酚(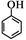 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物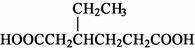 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
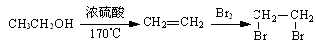
金属及其化合物的应用很广泛,现举几种常见金属及其化合物的用途,回答有关问题:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,其离子方程式为:_______________________________。
(2)黄铜矿熔炼后得到的粗铜中含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:_________________________________________。
(3)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从下表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
| 浓硫酸、稀硫酸、CuO、NaOH溶液 |
有关反应的化学方程式____________________________________________________。
劣质不锈钢腐蚀的实验现象________________________________________________。
(4)合金在生活和生产上用途越来越广泛。请用相关的知识解释在航空业上铝合金比铁合金用途更广泛的原因。
已知苯酚和甲醛在催化剂作用下可发生缩聚反应,生成酚醛树脂 。
。
(1)写出该反应的化学方程式:_____________________________________________。
(2)酚醛树脂一般为体型结构,试推测其基本性质:
①溶解性:________________;
②热塑性和热固性:________________;
③强度:________________;
④电绝缘性:________________。
(3)某种合成酚醛树脂的结构简式为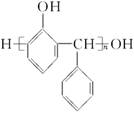
则合成它的单体是__________、________。
1,3丙二醇是生产新型高分子材料PTT的主要原料,目前1,3丙二醇的生产路线有:以石油裂解气为原料的两条石化合成路线和一条生物工程法合成路线。
【路线1】丙烯醛水合氢化法:
【路线2】环氧乙烷甲酰化法: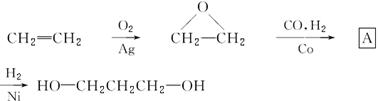
【路线3】生物发酵法:
淀粉 甘油
甘油 1,3丙二醇
1,3丙二醇
(1)A的结构简式为________________。
(2)从合成原料来源的角度看,你认为最具有发展前景的路线是________(填“1”、“2”或“3”),理由是____________________________________________________。
(3)以1,3丙二醇与对苯二甲酸为原料可以合成聚酯PTT,写出其化学方程式_______________。
(4)已知丙二酸二乙酯能发生以下反应: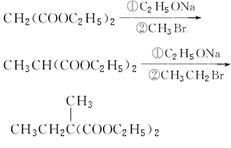 ,利用该反应原理,以丙二酸二乙酯、1,3丙二醇、乙醇为原料合成
,利用该反应原理,以丙二酸二乙酯、1,3丙二醇、乙醇为原料合成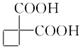 ,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
A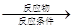 B
B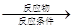 C……
C……
化学工作者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。
(1)工业上用乙烯和氯气为原料经下列各步合成PVC:
乙是PVC的单体,其结构简式为__________________________________________________,
反应①③的化学方程式分别为__________________________________________________、
________________________________________________________________________。
(2)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐(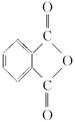 )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为
)是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为
________________________________________________________________________。
现有下列高分子化合物,请从下列各项中选择出最恰当的选项,将代号填入下表。
(1)高分子结构型式示意图: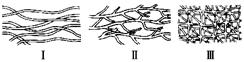
(2)高分子材料的主要性质特点:
| A.具有热塑性 |
| B.可溶于有机溶剂 |
| C.不溶于有机溶剂 |
| D.具有确定的熔点 |
(3)主要应用:(a)用于制备塑料薄膜;(b)用于制备光学仪器;(c)用于制备车辆轮胎
| 硫化橡胶 |
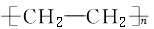 |
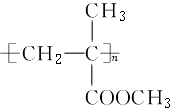 |
|
| (1) |
|||
| (2) |
|||
| (3) |