某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。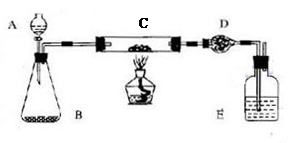
(一)实验目的:__________________________________。
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶等
药品:红褐色铜粉(含炭)样品、过氧化钠、碱石灰、水、浓硫酸等
(三)实验内容:
| 实 实验过程 |
实 实验现象 |
有 有关化学方程式 |
| 在C中加入样品标本W克,D中装入药品后并称量为m1克。连接好仪器后,检查气密性 |
|
|
| 打开A的活塞,慢慢滴加溶液。 |
|
|
| 对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: |
|
|
| 冷却后,称量D的质量为m2克。 |
|
|
(四)计算:样品中铜的质量分数=___________________(用含W、m1、m2的代数式表示)
(五)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与C之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是_______________,在B与C之间加入的装置可以是___________,其中盛放的药品是__________________。
(本题共10分)
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满。请回答下列问题:
23.X、Y、Z第一电离能由小到大的顺序为______<______<______(填元素符号)。
24.E元素基态原子的电子排布式为________________________________。
25.XZ2的分子中含有 个π键。
26.Z氢化物的沸点比Q氢化物的沸点高,理由是_____ 。
27.将YH3通入灼热EZ中发现黑色固体变红色,生成物对大气不造成污染。请写出有关化学方程式 。
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒。
汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断: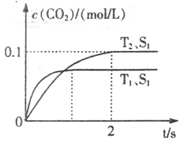
(1)该反应为 反应(填“放热”或“吸热”):在T2温度下,0~2s内的平均反应速率:v(N2)= ;
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在答题卡上画出 c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(3)某科研机构,在t1℃下,体积恒定的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度(具体数据见下表,CO2和N2的起始浓度为0)。
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/xl0-4mol L-1 |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
| c(CO)/xl0-3mol L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
t1℃时该反应的平衡常数K= ,平衡时NO的体积分数为 。
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(5)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g)△H=-867.0kJ • mol-1
2NO2 (g) 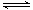 N2O4 (g)△H=-56.9kJ • mol-1
N2O4 (g)△H=-56.9kJ • mol-1
H2O(g) = H2O(l)△H=-44.0kJ • mol-1
写出CH4催化还原N2O4 (g)生成N2 (g)、CO2 (g)和H2O(l)的热化学方程式 。
课题组以甲苯为主要原料,采用以下路线合成化妆品防霉剂:对—羟基苯甲酸乙酯。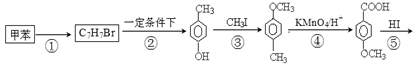
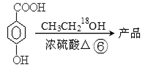
请回答:
(1)有机物C7H7Br的名称为 。
(2)产品的摩尔质量为 。
(3)在①~⑥的反应中属于取代反应的有 。
(4)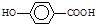 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
(5)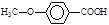 的同分异构体很多,其中符合下列条件有 种。
的同分异构体很多,其中符合下列条件有 种。
①遇到FeCl3溶液出现显色现象;②能发生水解反应;③能发生银境反应;④无-CH3结构。上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为 。
(6)高分子化合物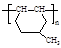 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: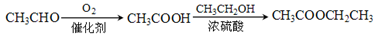
。
写出下列反应的化学方程式,并指出反应类型:
(1)实验室制乙烯 ()
(2)用甲苯制备TNT ()
(3)苯酚和浓溴水的反应 ( )
(4)1,2-二溴乙烷与足量氢氧化钠的乙醇溶液加热: ()
(5)2-丙醇与氧气在催化剂作用下反应 ( )
下图是某烃A分子的球棍模型。回答下列问题:
(1)A的名称是________________________;
(2)A能够发生的反应类型有____________(填序号);
A. 氧化反应 B. 加成反应 C. 消去反应
(3)A与溴的四氯化碳溶液反应的化学方程式是________________________________。