甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
⑴该反应的平衡常数表达式为 K = ___________________________。
⑵如图是该反应在不同温度下CO的转化率随时间变化的曲线。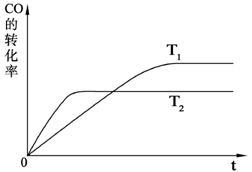
①该反应的焓变△H _____0(填“>”、“<”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是_________。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.使用合适的催化剂 | D.充入He,使体系总压强增大 |
⑶已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) △H=-a kJ·mol-1
② 2CO(g) + O2(g) = 2CO2(g) △H=-b kJ·mol-1
③ H2O(g) = H2O(l) △H=-c kJ·mol-1
则CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l) △H= ____________________ kJ·mol-1。
如图所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体②浓硫酸③硝酸铵固体④NaCl固体,其中能使a端液面高于b端液面的是__________________。(填序号)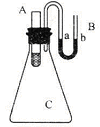
A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02gH2,用去0.4gA。B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体。
(1)写出两种元素的名称:A.B.。
(2)用结构示意图表示A、B两元素常见离子:
A.,B.。
(3) A、B形成的化合物中化学键的类型是。
一种不常见的离子化合物W,与氨气的组成元素相同,在受热分解时,生成甲、乙两种单质,且n(甲):n(乙)=5:1,相对分子质量M(甲)<M(乙),则W的化学式为,其与盐酸反应的化学方程式为 ,推测W应具有较强的性(填“氧化”或“还原”)。
W、X、Y、Z为短周期内除稀有气体元素外的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W的最外层电子数相等,X、Z为同一主族,Y、Z两种元素的质子数之和为W、X两种元素质子之和的3倍。由此可知元素W为,X为,Y为,Z。上述元素中任意三种元素组成的既含有离子键又含有共价键的化合物化学式为(至少写三种)。能形成共价化合物的化学式有、、、。
多数元素的原子不能稳定存在,形成化学键就是达到元素原子稳定存在形式的唯一目的。那么,请回答:
(1)水分子的组成为什么是H2O而不是H3O。
你的解释是 。
(2)稀有气体分子中为什么不存在化学键?
你的解释是。