一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 (填字母)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率为 ;②达到平衡时反应放出的热量为 ;③此温度下该反应的平衡常数K= 。
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
①温度关系:T1 T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA KB,KA KD。
可以用来鉴别甲烷和乙烯, 又可以用来除去甲烷中混有的少量乙烯的操作方法是
| A.混合气通过盛酸性高锰酸钾溶液的洗气瓶 |
| B.混合气通过盛足量溴水的洗气瓶 |
| C.混合气通过盛水的洗气瓶 |
| D.混合气跟氯化氢混合 |
已知卤代烃(R-X)在碱性条件下可水解得到醇(R-OH),如:CH3CH2-X+H2O 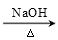 CH3CH2-OH+HR,现有如下转化关系:
CH3CH2-OH+HR,现有如下转化关系: 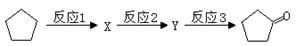
回答下列问题:
(1)反应1的试剂与条件为 __________,X的结构简式为______,Y的结构简式为______;
(2)写出反应3的方程式___________________________________。
某有机物的结构简式为: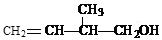
(1)该有机物中所含官能团的名称是_______________________________________;
(2)该有机物发生加聚反应后,所得产物的结构简式为_______________________;
(3)写出该有机物发生催化氧化的化学方程式(注明反应条件)_______________。
已知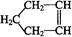 可简写为
可简写为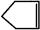 。降冰片烯的分子结构可表示为:
。降冰片烯的分子结构可表示为: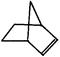
(1)降冰片烯属于__________。A.环烃 B.不饱和烃 C.烷烃 D.芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为 _________。
(4)降冰片烯不具有的性质__________。
A.能溶于水 B.能发生氧化反应 C.能发生加成反应 D.常温常压下为气体25.
写出下列相应的化学方程式
(1)乙烯→乙醇:(2)丙烯→聚丙烯:
(3)苯→溴苯:(4)苯→环己烷: