某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是 ,生成物是 ,化学方程式为 ;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____ ,若不能,则其原因为 _ ________________ ;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。
钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是(用离子方程式表示)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
正极的电极反应式为,电池工作时物质A可循环使用,A物质的化学式为。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 |
CH3COONa |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
11.6 |
10.3 |
11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是,根据表中数据,浓度均为0.01 mol·L-1下列四种酸的溶液分别稀释100倍,pH变化最大的是(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为。
②已知几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,(填离子符号)先沉淀,Ksp[Fe(OH)2]Ksp[Mg(OH)2](填“>”、“=”或“<”)。
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
请回答下列问题:
(1)ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=。
(2) 反应Ⅲ的化学平衡常数表达式为 。
(3)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①ΔH30(填“>”、“=”或“<”)。
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是
。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化总趋势曲线。

图1图2
(4)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有
。
(5)下列物质中也可以作为CO2捕获剂的是。
| A.NH4Cl | B.Na2CO3 | C.HOCH2CH2OH | D.HOCH2CH2NH2 |
(10分)在研究原子核外电子排布与元素周期表的关系时,人们发现外围电子排布相似的元素集中在一起。据此,人们将元素周期表重新分为五个区。在1-36号元素中
(1)在s区中,族序数最大的元素,其原子的价电子的电子云形状为。
(2)在d区中,人类使用最早,应用最广泛的元素的常见离子的电子排布式为, 。
(3)在ds区中,原子序数最大的元素,原子的价电子排布式为。
(4)在p区中,第2周期、ⅤA族元素原子价电子的轨道表示式为。
(10分)化学在生活中有很多的应用,如臭氧可用于空气净化、饮用水消毒、工业废物处理和作为漂白剂等,氮化硅(Si3N4)是一种新型陶瓷材料,具有较高的硬度且耐高温。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。已知:
 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为
 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
(2)氮化硅()可由石英与焦炭在高温的氯气流中通过如下反应制得:
在VL的密闭容器中进行反应,实验数据如下表: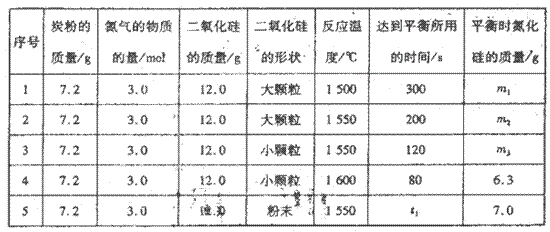
①实验l和实验2表明,________对反应速率有影响,对同一规律研究的实验还有一组是________(填实验序号)。本实验还研究了_______对反应速率的影响。。
②实验5中,t1________(填“>”、“<”或“=”)120,平衡时,二氧化硅的转化率为____________________。
(l1分)物质A-E都是中学化学中常见的物质,它们可以发生如下图所示的反应,其中E是蓝色溶液。
(1)在以上反应中(用序号填空),属于氧化还原反应的是____________,属于离子反应的是____________。
(2)写出反应③的离子方程式:____________________________________________。
(3)反应⑦的速率如上图,其原因可能是________________________________。
(4)从上述框图中选取电极材料和电解质溶液组成原电池,其中正极材料是________________________。负极反应为________________________________。