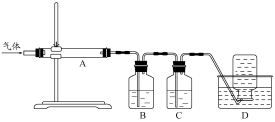
(1)常温下,0.1mol·L-1的醋酸和0.1mol·L-1的盐酸各100mL分别与足量的锌粒反应,产生的气体体积前者____________后者。(填“大于”“等于”“小于”)
(2)常温下0.1mol·L-1的醋酸和pH=1的醋酸各100mL分别与足量的锌粒反应,产生的气
体前者比后者 。
(3)在25℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字母,
下同)
A、5 B、7 C、3 — 5之间 D、5 — 7之间
(4)25℃时,向0.1mol·L-1的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH将 。
A、增大 B、减小 C、不变 D、无法确定
(5)室温下,向0.1mol·L-1的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不
影响H2的体积,可以向硫酸溶液中加入 试剂。
A、碳酸钠晶体 B、醋酸钠晶体 C、滴加少量的硫酸铜溶液 D、水
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 ,
a. Fe2O3 b. NaCl c. Cu2S d. Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)下图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为 ,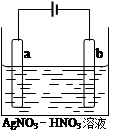
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
H2S04溶解A1203的离子方程式是
KMnO4 - 氧化Fe2+的离子方程式补充完整: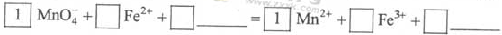
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的:
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2,
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 .
② Ⅳ 中加入MnS04的目的是
合金是建筑航空母舰的主体材料。
⑴航母升降机可由铝合金制造。
①铝元素在周期表中的位置是 。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为 。
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为 。焊接过程中使用的保护气为 (填化学式)。
⑵航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为 。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为
⑶航母螺旋浆主要用铜合金制造。
①80.0gCu-Al合金用酸完全溶解后,加入过量氨水,过滤得到白色沉淀39.0,则合金中Cu的质量分数为
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合题8图信息推断该合金中除铜外一定含有 。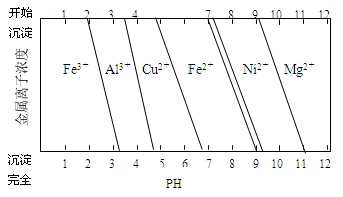
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3="==" FeCO3↓+Na2SO4FeCO3+C6H8O7="==" FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Al3+ |
3. 0 |
5. 0 |
| Fe2+ |
5. 8 |
8. 8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4溶液, ,得到FeSO4·7H2O 晶体。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下: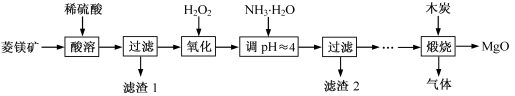
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2 的成分是 (填化学式)。
|
(4)煅烧过程存在以下反应:
|
2MgSO4+C="==" ="==" 2MgO+2SO2↑+CO2↑
|
MgSO4+C="==" ="==" MgO+SO2↑+CO↑
MgSO4+3C="==" ="==" MgO+S↑+3CO↑