请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光 B.焰色反应 C.原子光谱 D.燃烧放热 E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有___________(填元素符号)
②在a:苯 b:CH3OH c:HCHO d:CS2 e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子有___________(填字母),CS2分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O) 6]2+显粉红色。据此判断,[Mn(H2O) 6]]2+ _____________(填“无”或“有”)颜色
(4) 请写出HClO的电子式:_______________________;在下图配合物离子[Cu(NH3)4]2+.中的画出配位键:
(5) A、B均为短周期金属元素。依据下表数据和已学知识,
| 电离能/KJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
判断金属B的价电子电子排布式______,写出金属B与二氧化碳反应的化学方程式: _______________________________________________。
(14分)2010年在我国北方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为 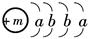 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=_____,该融雪剂的化学式为_______。
(2)Z、W元素名称分别为_______、_______。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式:X2+[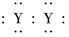 ]2-
]2-
B.WZ2的结构式:Z===W===Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程为: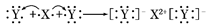
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是
。
某可逆反应在0—2分钟的进行过程中, 在不同反应时间各物质的量的变化情况如右图所示。则该反应的反应物是,生成物是,此反应(填“是”或“不是”)可逆反应;反应开始至2分钟时,(填“能”或“不能”)用C表示反应速率,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了状态,此时正反应速率(填 “等于”或“不等于”) 逆反应速率。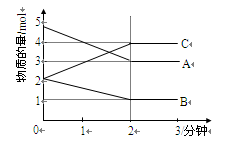
回答下列问题
(1)在2FeBr2+3Cl2=2FeCl3+2Br2的反应中,被氧化的元素是_____________
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2);浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2)。则Cl2、Fe3+、MnO4-氧化性由强到弱的顺序是____________________。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式____________________________________________。
(4)在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+2OH-=RO42-+2Cl-+H2O
由以上反应可知在上述过程中RO3n-被________________(填“氧化”或“还原”),RO3n-中元素R的化合价是______________。
(1)除去SiO2固体中混有的Al2O3,方法是:;
其离子方程式为:。
(2)除去FeCl2溶液中的少量FeCl3,方法是;其离子方程式为:。
(3)除去Na2CO3固体中的少量NaHCO3,方法是:;其化学方程式为:;
金属的性质与其结构有密切的关系,金属晶体由于某些结构上的相似点导致了金属具有一些共同的性质;同样由于结构上的不同点,导致了每种金属都具有各自的特性。
(1)请指出金属具有延展性的原理是
(2)金属的紧密堆积有不同的形式,请画出金属钠的晶胞,并指出一个晶胞含有几个钠原子?
(3)计算该晶胞的空间利用率?