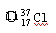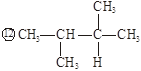现有25 ℃时0.1 mol/L的氨水,请回答以下问题:
(1)①若向该氨水中加入少量氯化铵固体,NH3·H2O的电离平衡_______(“向左”、“向右”或“不”)移动,此时溶液中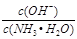 ________(填“增大”、“减小”或“不变”),在该过程中,水的离子积常数Kw (填“增大”、“减小”或“不变”);
________(填“增大”、“减小”或“不变”),在该过程中,水的离子积常数Kw (填“增大”、“减小”或“不变”);
②若向该氨水中加入稀盐酸,使其恰好完全中和, 所得溶液的pH 7(填“>”、“<”或“=”),用离子方程式表示其原因 ,
所得溶液中各离子物质的量浓度由大到小的顺序为 。
③若向该氨水中加入稀盐酸,所得溶液的pH=7,则溶液中[NH4+] [Cl-](填“>”、“<”或“=”)
(2)已知某弱酸的难溶物CaA在水中存在溶解平衡:CaA(s)
 Ca2++A2- ΔH>0,
Ca2++A2- ΔH>0,
一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关。
①温度升高时,Ksp (填“增大”“减小”或“不变”,下同)。
②向浊液中通入HCl气体c(Ca2+) 。
③测得25 ℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol·L-1,则溶液中c(A2-)= 。
按要求写出化学方程式:
⑴电解饱和食盐水:;
⑵足量的铁粉和氯气反应:;
⑶镁条和二氧化碳反应:。
(11分)下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
| 编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
| 名称 |
酒精 |
醋酸 |
火碱 |
食盐 |
铜导线 |
亚硫酸酐 |
苏打 |
| 主要 成分 |
CH3CH2OH |
CH3COOH |
NaOH |
NaCl |
Cu |
SO2 |
Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):
属于盐的是,属于电解质的是,属于非电解质的是;
(2)写出过量②的水溶液与⑦反应的化学方程式,
少量盐酸与⑦反应的离子方程式。
⑶某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
请标出电子转移的方向和数目;当电子转移0.1mol时,消耗还原剂的质量为g。
(2分) NaCl,NaBr,NaI三种溶液可用一种试剂将它们鉴别出来,这种试剂是。
如下图所示,将活性炭投入盛满黄绿色氯气的集气瓶中,立即塞上单孔塞。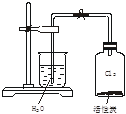
(1)轻轻摇动集气瓶,可看到的现象是_________。
(2)打开橡皮管上的夹子,看到的现象是_________。
(3)上述实验现象表明____________________________。
下列物质中,互为同分异构体的有。
互为同素异形体的有。
属于同位素的有。
属于同一种物质的有。
①液氯 ②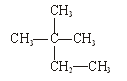 ③白磷 ④氯气
③白磷 ④氯气
⑤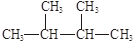 ⑥氯水 ⑦
⑥氯水 ⑦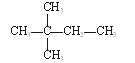
⑧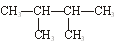 ⑨
⑨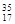 Cl ⑩红磷
Cl ⑩红磷