(12分)目前工业上可用CO2来生产燃料甲醇,其反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49kJ/mol。现进行如下实验:在体积为2 L的密闭容器中,充入2molCO2和6molH2,在一定温度下发生反应并达平衡,实验中测得CO2和CH3OH(g)的浓度随时间变化如图:
CH3OH(g)+H2O(g)△H=-49kJ/mol。现进行如下实验:在体积为2 L的密闭容器中,充入2molCO2和6molH2,在一定温度下发生反应并达平衡,实验中测得CO2和CH3OH(g)的浓度随时间变化如图:
(1)从反应开始到平衡,CO2的平均速率为 ;
(2)下列说法中正确的是 ;
A、某时刻时混合气体的密度、平均相对分子质量不变均可说明该反应达平衡状态
B、单位时间内消耗3mol H2的同时消耗1 mol CH3OH,可说明该反应达平衡状态
C、反应达平衡时H2的转化率为75%
D、2 mol CO2和6 mol H2反应达到平衡时放出98.0KJ热量
E、达平衡之后改变条件若平衡发生移动。该反应的平衡常数一定改变
(3)下列措施中既能加快该反应速率又能使CO2的转化率增大的是(填字母代号) ;
A、加入催化剂 B、升高温度 C、恒温恒容下充入He(g) D、再充入l mol CO2和3 mol H2
(4)该温度下的平衡常数为(用分数表示) ;
(5)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2 (g)+3H2 (g);△H=+49.0kJ/mol
②CH3OH(g)+1/2O2 (g)=CO2 (g)+2H2 (g);△H="-192.9" kJ/ mol
由此可推知:CH3OH(l)+1/2O2 (g)=CO2 (g)+2H2 (g)的△H -192.9 KJ/mol(填“>”“<”或“=”);又已知:H2O(g)= H2O (l);△H=-44.0 KJ/mol,则CH3OH(g)的燃烧热为 。
Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 = 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2该电池正极发生的反应的电极反应式为 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。
查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH- = FeO42-+4H2O和 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的 I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是用离子方程式解释 .
(3)在100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有1/4的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式____ 。向反应后的溶液中通入过量CO2,反应的离子方程式为 _______________________________。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式 ,反应中生成0.2mol HNO3,转移的电子数目为 。②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是 。
【化学选修3:物质结构与性质】
(1)美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型。多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 。
A、NO2-和NH4+ B、H3O+和ClO3- C、NO3-和CO32-D、PO43-和SO42-
(2)铜、锌两种元素的第一电离能、第二电离能如表所示
| 电离能/kJ·mol-1 |
I1 |
I2 |
| 铜 |
746 |
1958 |
| 锌 |
906 |
1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 。
(3)石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体。其结构如图: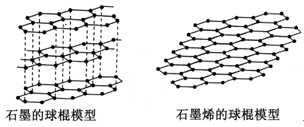
有关说法正确的是
A、固态时,碳的各种单质的晶体类型相同 B、石墨烯中含有非极性共价键
C、从石墨中剥离石墨烯需要破坏化学键 D、石墨烯具有导电性
(4)最近科学家成功以CO2为原料制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以4个共价单键与氧原子结合为一种空间网状的无限延伸结构,则该晶体中碳原子采用 杂化与周围氧原子成键;晶体中碳氧原子个数比为 ;碳原子数与C-O化学键数之比为 。
(5)已知钼(Mo)的晶胞为体心立方晶胞,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏伽德罗常数的值,请写出金属钼密度的计算表达式 g/cm3。
【化学选修2: 化学与技术】
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹。
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式 。
(2)一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
①净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
②在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度 ;体系中要通入适量的氢气是为了 。
③X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(3)工业上可以通过如下图所示的流程制取纯硅: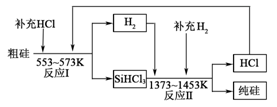
①整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应,写出该反应的化学方程式 。
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%。则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用。
(1)请写出工业上由NH3制取NO的化学方程式 。
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+ CO2(g) FeO(s)+ CO(g),已知该反应的平衡常数K与温度T的关系如图所示。
FeO(s)+ CO(g),已知该反应的平衡常数K与温度T的关系如图所示。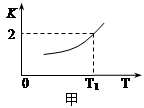
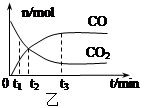
①该反应的逆反应是 (填“吸热”或“放热”)反应。
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是 。
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)= v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示。则CO2的平衡转化率为 ,平衡时混合气体的密度与起始时气体的密度之比为 。
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特定见下表。
2NH3,有关数据及平衡状态特定见下表。
| 容器 |
起始投入 |
达平衡时 |
|||
| 甲 |
2 mol N2 |
3 mol H2 |
0mol NH3 |
1.5mol NH3 |
同种物质的体积分数相同 |
| 乙 |
a mol N2 |
b mol H2 |
0mol NH3 |
1.2mol NH3 |
起始时乙容器中的压强是甲容器的 倍。
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量。生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 倍。请写出该反应的热化学方程式 。
倍。请写出该反应的热化学方程式 。