(10分)在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 |
K+Al3+Mg2+Ba2+ Fe3+ |
| 阴离子 |
NO3-CO32-SiO32-SO42-OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀盐酸 |
产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4 g |
| Ⅲ |
向Ⅱ的滤液中滴加BaCl2溶液 |
无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的离子是____ ____。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)。
| 阴离子 |
浓度c/(mol·L-1) |
| ① |
|
| ② |
|
| ③ |
|
| ④ |
|
| ⑤ |
|
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:______________。
如下图所示的操作和实验现象,能证明苯酚的两个性质。则
性质Ⅰ是,操作1是、操作2是。
性质Ⅱ是,操作1是、操作2是。
写出所发生的化学方程式:;。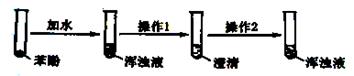
已知烯烃、炔烃在臭氧的作用下发生以下反应:
CH3-CH=CH-CH2-CH=CH2 CH3CHO+OHC-CH2-CHO+HCHO
CH3CHO+OHC-CH2-CHO+HCHO
CH3-C C-CH2-C
C-CH2-C CH
CH CH3COOH+HOOC-CH2-COOH+HCOOH
CH3COOH+HOOC-CH2-COOH+HCOOH
某烃分子式为C10H10,在臭氧作用下发生反应:
C10H10 CH3COOH+3HOOC-CHO+CH3CHO
CH3COOH+3HOOC-CHO+CH3CHO
(1) C10H10分子中含有个双键,个三键。
(2) C10H10分子结构简式为。
(1)分子式为C7H8O的芳香族化合物中,与FeCl3溶液混合后显紫色和不显紫色的物质分别有3种和2种,各写出其中的一种(写出结构简式):;。
举出学过的2个例子说明芳香化合物侧链对苯环的影响,用化学方程式表示;。
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题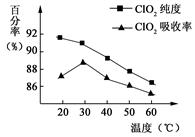
(1)据图可知,反应时需要控制的适宜温度是℃,达到此要求采取的适宜措施是。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式:。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol· (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol· K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=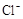 +5Fe3+ +2H2O14H+ +
+5Fe3+ +2H2O14H+ +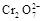 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
①2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
②CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3=kJ·mol-1。
6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3=kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示: 11P4+60CuSO4 +96H2O 20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是。
20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。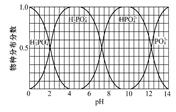
①为获得尽可能纯的NaH2PO4,pH应控制在; pH=8时,溶液中主要含磷物种浓度大小关系为。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是(写离子方程式)。
(4)磷的化合物三氯氧磷(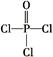 )与季戊四醇(
)与季戊四醇(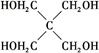 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
①酸性气体是(填化学式)
②X的结构简式为。