(18分)Ⅰ.(8分)次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性。试回答下列问题:
(1)P的原子结构示意图为 ;
(2)NaH2PO2为 (填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 。
(3)H3PO2可将溶液中的银离子还原为银单质,若该反应的氧化产物的化学式为H3PO4 , 则氧化剂与还原剂的物质的量之比为 。
Ⅱ.无机化合物A主要用于有机合成和药物制造,是具有良好前景的储氢材料。A中含有金属Li元素,遇水强烈水解,对化合物A加强热则其会发生分解反应(非氧化还原反应),生成化合物E和气体C。在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况)。已知气体C极易溶于水得到碱性溶液, 电解无水B可生成金属单质D和氯气。请回答下列问题:
(1)A的化学式是 ,C的电子式是 。
(2)写出化合物A与足量盐酸反应的化学方程式: 。
(3)物质A在加强热分解的化学方程式为: 。
(1)原子核内无中子的元素可放在元素周期表的族,又根据最高正化合价和负化合价的绝对值相等可放在族,该元素还可放在元素周期表的族。它的核外电子排布式为,它和氧元素可形成的化合物的电子式为。
(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。

A B
则A、B两幅图中能表示“热冰”的示意图为。使水结成“热冰”采用“弱电场”的条件,说明水分子是分子。(选填“极性”或“非极性”)
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+)。这种阳离子具有较强的氧化性,试写出该离子与H2S的水溶液反应的离子方程式;该反应破坏的化学键是。
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g) CO(g)+H2(g),其中H2O 、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
CO(g)+H2(g),其中H2O 、CO的物质的量(mol)随时间(min)的变化曲线如图所示: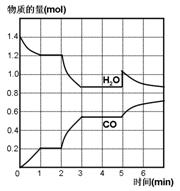
(1)该反应的化学平衡常数表述式为__________________
(2)计算1min内υ(CO)=______________
(3)反应处于平衡状态的时间区间是_______________
(4)若反应进行到2min时,改变了温度,使曲线发生如右图所示的变化,则温度为______(选填“升高” 或“降低”)逆反应是____________(选填“吸”或“放”)热反应。
(5)反应至5min时,若也只改变了某一个条件,使曲线发生如图所示变化,该条件可能是下述中的_________________。
| A.增加了C | B.增加了水蒸气 | C.降低了温度 | D.增加了压强 |
有三溶液:a.Ba(OH)2,b.NaOH,c.NH3·H2O
(1)pH值相等时,三种溶液浓度由大到小的顺序为_________________
(2)物质的量浓度相等时,pH值由大到小的顺序为_________________
(3)pH=11时,各100mL与同浓度的HCl中和,消耗HCl体积由多到少的顺序为________________
(4)浓度相等时,各100mL与同浓度HCl中和,消耗HCl体积由多到少的顺序为_______________
NH4+、NO3-、HSO4-、HCO3-、CO32-、HCl等微粒中,在水溶液里能电离而不能水解的有___________;能水解而不能电离的有___________;既能水解又能电离的有__________;既不能水解又不能电离的有___________。写出其中既能水解又能电离的微粒的电离方程式及水解方程式_______________________,_________________________。
25℃时,KSP[Mg(OH)2]=5.6×10-12, KSP[MgF2]=7.42×10-11,在该温度下进行下列实验,回答相关问题:
(1)在同浓度的含OH-和F-的溶液中,逐滴加MgCl2溶液时,最先产生的沉淀是____①____
(2)Mg(OH)2可溶液于浓NH4Cl溶液,试解释产生该现象的原因___②___(用离子方程式表示)
(3)有人认为“难溶盐不能和碱溶液发生复分解反应”。若在MgF2悬浊液中滴加NaOH溶液,能否发生化学反应?若你认为能反应的,请写出该反应的离子方程式;若你认为不能反应的请说明理由。____③____