NH4+、NO3-、HSO4-、HCO3-、CO32-、HCl等微粒中,在水溶液里能电离而不能水解的有___________;能水解而不能电离的有___________;既能水解又能电离的有__________;既不能水解又不能电离的有___________。写出其中既能水解又能电离的微粒的电离方程式及水解方程式_______________________,_________________________。
(I)多项选择题
CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是。
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp2杂化,所有原子均共面 |
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(II)
锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置:周期,族,区。
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式;葡萄糖分子中碳原子杂化方式有。
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。

(4)右上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为;该化合物的晶体熔点比干冰高得多,原因是。
(I)多项选择题
莽草酸是一种合成治疗甲型H1N1流感药物达菲的原料。鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机物的说法不正确的是。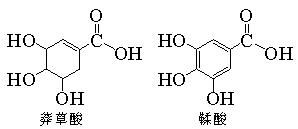
| A.两种酸都能与溴水反应 |
| B.两种酸遇三氯化铁溶液都显紫色 |
| C.鞣酸分子与莽草酸分子相比多了两个碳碳双键 |
| D.等物质的量的两种酸与足量金属钠反应时,产生氢气的量相同 |
E.等物质的量的两种酸与足量氢氧化钠溶液反应时,消耗氢氧化钠的量相同
(II)
近年来,金属有机化合物的研究越来越引起化学家的重视,其研究成果已应用于有机合成。
(一)二茂铁[Fe(C5H5)2]是铁的一种金属有机化合物,结构如右图
(E表示铁),其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: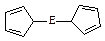 。核磁共振法能够区分这两种结构,在核磁共振氢谱中,正确的结构有种峰,错误的结构有种峰。
。核磁共振法能够区分这两种结构,在核磁共振氢谱中,正确的结构有种峰,错误的结构有种峰。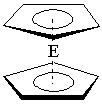
(二)Grignard试剂是镁的一种金属有机化合物,它的合成方法是:
RX+Mg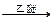 RMgX(Grignard试剂)
RMgX(Grignard试剂)
生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇: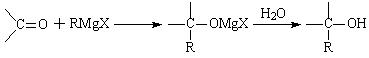
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:(提示:H的一氯代物只有3种)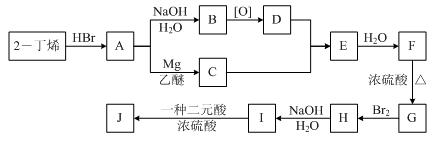
请按要求填空:
(1)3,4-二甲基-3-己醇的结构简式是,它是图示中的哪种物质(填A~J的符号)。
(2)C+D→E的反应类型是______________,F→G的反应类型是________________。
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B:。
(4)图示中的二元酸的名称是;I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物。试写出此高聚物的结构简式。
有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与Br2的四氯化碳溶液发生加成反应,1 mol A能与1molNaHCO3溶液恰好完全反应。B所含元素种类与A相同,相对分子质量为46,其中碳的质量分数为
52.2%,氢的质量分数为13%。试回答下列问题:
(1)A中所含官能团的名称为。
(2)B的分子式为,B的同系物D的相对分子质量为60,则D可能的结构简式为。
(3)A与B反应生成C的化学方程式为,
该反应属于反应。
(4)A、B的混合物共1mol,无论二者以何种比例混合,完全燃烧时下列量始终为定值的是。
a. 消耗氧气的量 b. 生成水的量 c. 生成二氧化碳的量
由硫可制得多硫化钠Na2Sx,x的值一般为2~6。当x=2时,多硫化钠称为过硫化钠。
Ⅰ.过硫化钠加入盐酸中有硫沉淀析出,写出该反应的化学方程式,该反应的还原产物是。
Ⅱ.某些多硫化钠可用于制作蓄电池。下图是一种正在投入生产的大型蓄电系统的原理图。
电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:


(1)电池中的左侧“电极”的电极名称是(填“正极”或“负极”)。
(2)放电过程中钠离子从(选“左到右”或“右到左”)通过离子交换膜。
(3)写出充电过程中阳极的电极反应式。
在容积为2L的密闭容器中,进行反应:A(g)+2B(g) C(g)+D(g)
C(g)+D(g)
在不同温度下,D的物质的量n(D)和时间t的关系如图所示。试回答下列问题:
(1)800℃时,0—5min内,以B的浓度变化表示的平均反应速率为。
(2)能判断该反应达到化学平衡状态的依据是。
a.容器中压强不变b.混合气体中c(A)不变
c.2v正(B)=v逆(D)d.A、B、C、D四者共存
(3)该反应的正反应为反应(填吸热或放热);判断的理由是。
(4)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K(要求有计算过程)。