有三溶液:a.Ba(OH)2,b.NaOH,c.NH3·H2O
(1)pH值相等时,三种溶液浓度由大到小的顺序为_________________
(2)物质的量浓度相等时,pH值由大到小的顺序为_________________
(3)pH=11时,各100mL与同浓度的HCl中和,消耗HCl体积由多到少的顺序为________________
(4)浓度相等时,各100mL与同浓度HCl中和,消耗HCl体积由多到少的顺序为_______________
过氧化氢(H2O2)有广泛的用途,过氧化氢的沸点为150℃。工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理是:2NH4HSO4 (NH4)S2O8+H2↑,(NH4)2S2O8+2H2O=2NH4HSO4+H2O2。其流程如下:
(NH4)S2O8+H2↑,(NH4)2S2O8+2H2O=2NH4HSO4+H2O2。其流程如下:
请回答下列问题:
(NH4)2S2O8中硫元素的化合价为_______。
(2)过氧化氢具有的化学性质是______。(填字母)。
| A.不稳定性 | B.弱碱性 | C.氧化性 | D.还原性 |
(3)根据以上反应原理可知,电解硫酸氢铵溶液时,阳极的电极反应方程式是:
_______________________________________
(4)在上面流程图中,采用减压蒸馏的原因是:____________________________.
可循环利用的物质是_____________。
(5)硫酸铜酸性溶液中混有少量硫酸亚铁,为除去杂质,用过氧化氢把硫酸亚铁氧化,反应的离子方程式是________________________________________________________。
若X、Y两种元素在周期表中位于同一主族,其中一种为短周期元素,且两者相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):
Xm + Yn + H2O → HXO3 + HY。请回答:
⑴该反应的还原剂的电子式为___________________。
⑵配平上述化学方程式(用化学式表示):
⑶若某化学反应如下:(未配平)KX+ Yn + H2O → KXO3 + Xm+ HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目:
KX+ Yn + H2O →
⑷已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下: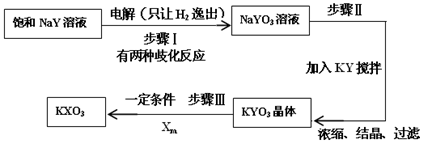
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中由NaYO歧化生成NaYO3的离子方程式为(用化学式表示):______________________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。在2L 3 mol·L-1的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1 mol·L-1。[已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变]
A~G均为有机化合物,它们之间的转化如下图所示:
已知以下信息:
a.A是以淀粉为原料生产的一种常见有机物; b. G是六元环酯;
c. E能发生银镜反应,且1molE能与4molAg(NH3)2OH反应。
请回答下列问题:
(1)C的系统命名为;D的官能团是。F的分子式为;
(2)②④⑤的反应类型分别是②,④⑤;
(3)写出指定过程的化学反应方程式:
C→D:;
D+F→G:。
(4)写出满足下列条件物质的结构简式
①是B的同系物;②在其同系物中含碳原子数最少;③具有顺反异构现象
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备 NF3的化学反应方程式:。
(2)NF3的沸点比NH3的沸点(-33 ℃)低得多的主要原因是。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为_ ___其中心离子是,配位数为。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是和。
②T元素最可能是区元素。若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为,其中心原子的杂化方式为。
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
| A.升高温度 | B.增大压强 | C.充入一定量氮气 | D.再加入一些铁粉 |
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”),该反应的平衡常数K= ,温度升高,K (填“增大”、“减小”、“不变”)。
(4)铁的重要化合物在生产生活中应用十分广泛。高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。
(6)已知Ksp(Fe(OH)3)= 8´10-38,某溶液中含有Fe3的浓度是0.05mol×L-1。如果要使Fe(OH)3沉淀完全pH至少为 (溶液中离子浓度小于1×10-5mol/L时,沉淀完全,lg2=0.3)