二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。
(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:
2SO2(g)+O2(g) 2SO3(g) △H="a" kJ·mol-1
2SO3(g) △H="a" kJ·mol-1
在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______ K2 (填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为_________________________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=_______;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将___(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:
上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为_______________________。
 某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb=。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb=。
用如图所示的装置进行电解。A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。则:
(1)电源的F端为_____________极。
(2)A中发生反应的化学方程式为________________。
(3)在B中观察到的现象是____,_________,_________
(4)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168L,,B中析出硫酸钠晶体(Na2SO4﹒10H2O) ωg。若电解过程中无其他副反应发生,经测定电解后,A中溶液体积恰为1000mL,则①A溶液的pH为______________。
②电解前饱和Na2SO4溶液的质量分数为________________(列出算式即可。)
已知:① C(s)+O2(g)=CO2(g);DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g);DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
。
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):
Cu(NH3)2Ac + CO + NH3 = Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为 ▲。
(2)写出基态Cu+的核外电子排布式 ▲。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 ▲。
(4)写出与CO互为等电子体的离子 ▲。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为 ▲;1 mol尿素分子中,σ键的数目为 ▲。
(6)铜金合金形成的晶胞如上图所示,其中Cu、Au原子个数比为 ▲。
过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下: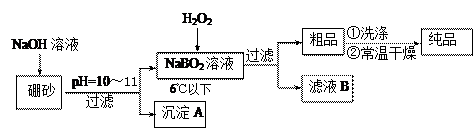
(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为 ▲;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁。若加碱前溶液中c(Mg2+)=0.056 mol•L-1,那么需调节溶液的pH= ▲时,才开始出现沉淀。[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B): n(H) :n(O)="1:" 1: n: 7。将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如图所示,则T3时所得晶体的化学式为___▲___。(书写简单计算过程)
(4)若反应温度控制不当,所得的过硼酸钠晶 体中将混有NaBO2 ,则产品中钠的质量分数▲(填 “升高”、“降低”或“不变”)。
体中将混有NaBO2 ,则产品中钠的质量分数▲(填 “升高”、“降低”或“不变”)。