元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________ 。
A.原子半径和离子半径均减小
B.金属性减弱,非金属性增强
C.氧化物对应的水化物碱性减弱,酸性增强
D.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最强的简单阳离子是 。
(3) Si和HCl反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
(4)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是_____ 。
A.NH3 B.HI C.H2S D.SO2
(5)①CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示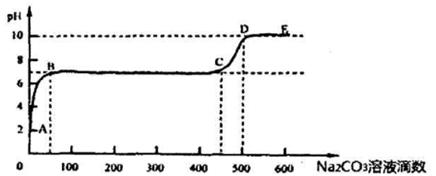
请用离子方程式表示B-C段发生的反应: 。
氯碱工业中电解饱和食盐水的原理示意图如下图所示: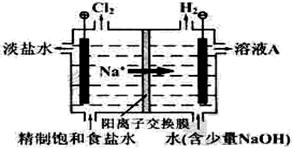
(1)溶液A的溶质是(写化学式);电解饱和食盐水的离子方程式是;
(2)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
(3)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。
精制流程如下(淡盐水和溶液A来自电解池):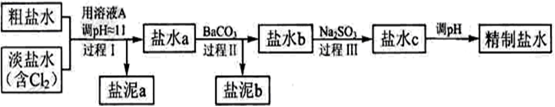
①盐泥a除泥沙外,还含有的物质是。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
化合物G的合成路线如下: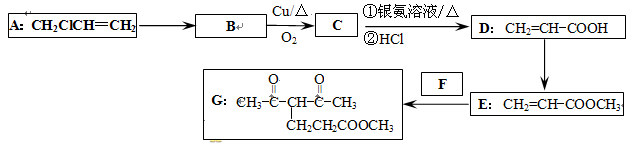
(1)D中含氧官能团的名称为,D的分子式为,1 mol D完全燃烧所需氧气为mol;
(2)写出A→B的化学反应方程式。
(3)写出C→D的化学反应方程式。
(4)反应E + F→G属于下列麦克尔加成反应类型,则F的结构简式为。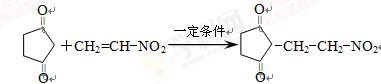
(5)比G少2个氢原子的物质具有下列性质:①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有一种;③1mol物质最多可消耗2mol Na和1mol NaOH。任写一种该物质的结构简式。
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下: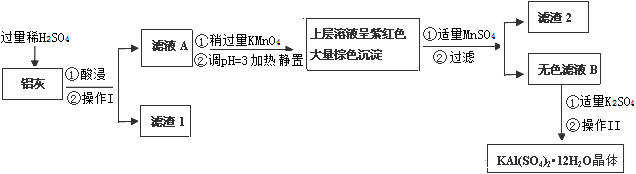
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是,操作Ⅱ是蒸发浓缩、、过滤、、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是(只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+)。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:。滤渣2含有的物质是。
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
请回答下列问题:
(1)ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=。
(2)反应Ⅲ的化学平衡常数表达式为 。
(3)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①ΔH30(填“>”、“=”或“<”)。
②在T1~T2温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是
。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将
该反应体系温度迅速上升到T2,并维持该温度。已知同浓度的(NH4)2CO3和NH4HCO3溶液
pH前者大,请在下图中画出t1时刻后溶液的pH变化总趋势曲线。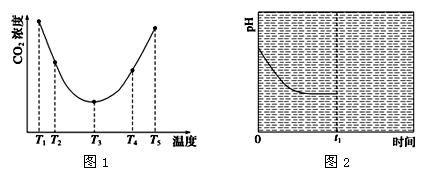
(4)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有。(答出一点即可)
(5)下列物质中也可以作为CO2捕获剂的是。
A.NH4Cl B.Na2CO3C.HOCH2CH2OH
某新型液晶有机物基元IV的合成线路如下: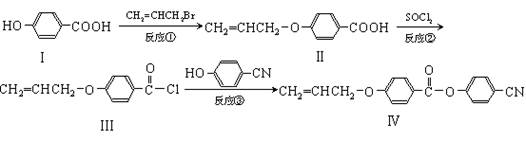
(1)Ⅰ的分子式,Ⅰ中含氧官能团的名称,反应①的类型为。
(2)CH2=CHCH2Br与NaOH水溶液反应的化学方程式。
(3)II可发生加聚反应,所得产物的结构简式。
(4)有关化合物Ⅰ和II的说法中,不正确的是。
| A.1molⅠ充分燃烧需要消耗6mol O2 |
| B.1molⅠ最多可消耗2mol NaOH |
| C.1mol II最多与5mol H2发生加成反应 |
| D.II能使酸性KMnO4溶液褪色 |
(5)一定条件下,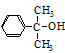 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是。
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是。
(6)化合物I的同分异构体中,苯环上一溴代产物只有两种,遇FeCl3溶液显紫色,还能发
生银镜反应的化合物有多种,写出其中一种同分异构体的结构简式。