A 、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,非金属性较强的元素在周期表中的位置为 ,以下三种说法中,可以验证C和E非金属性强弱的是 。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素显负价
c.比较这两种元素的气态氢化物的稳定性
(2)用元素符号表示B,C,D三种元素的第一电离能由大到小的顺序为 。
(3)盐M中含有的化学键类型有 ,B的最高价含氧酸N,常温下,若M,N两种溶液的pH均等于5,则由水电离出的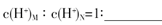
(4)D元素的最高价氧化物对应水化物能与地壳中含量最多的金属元素形成的单质反应,试写出该反应的离子方程式 ,用离子方程式表示该反应生成的盐溶液显碱性的原因
(5)C和D按原子个数比1:1形成一种离子化合物R,已知常温时R与水反应,恢复至原状态测得:每转移1 mol电子放出QkJ的热量,试写出R与水反应的热化学反应方程式 。
将4 mol A气体和2 mol B气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 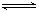 2C(g)若经2s 后测得C的浓度为0.6mol•L-1,那么,
2C(g)若经2s 后测得C的浓度为0.6mol•L-1,那么,
(1)用物质A表示的反应的平均速率为,
用物质B 表示的反应的平均速率为。
(2)2s时物质B的浓度为,
2s时物质A的转化率为 。
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A:4HCl(g) +O2(g) Cl2 (g)+2H2O (g)
Cl2 (g)+2H2O (g)
已知:i.反应A中, 4mol HC1被氧化,放出115.6kJ的热量。 ii.
ii.
H2O的电子式是_______________。
反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中
H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知 N2(g)+2O2(g)="===2" NO2(g);△H="+67.7" kJ·mol-1,
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________。
(5)已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H =" +" 67.7kJ/mol
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的
热化学方程式: ________________________________。
①CaCO3=" CaO" + CO2ΔH=+177.7kJ·mol-1
②C(s) + H2O(g) =" CO(g)" + H2(g)ΔH=131.3kJ·mol-1
③1/2 H2SO4(aq) + NaOH(aq) =1/2Na2SO4(aq) + H2O(l)ΔH= —57.3kJ
④C(s) + O2(g) = CO2(g)ΔH=—393.5kJ·mol-1
⑤CO(g) + 1/2O2(g) = CO2(g)ΔH=—283kJ·mol-1
⑥HNO3(aq) + NaOH(aq) = NaNO3(aq) + H2O(l)ΔH=—57.3kJ·mol-1
(1)上述热化学方程式中,不正确的有;
(2)上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有。
某温度时,在10 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
2.00 |
0.00 |
| 1 |
0.90 |
1.80 |
0.20 |
| 3 |
0.75 |
1.50 |
0.50 |
| 5 |
0.65 |
1.30 |
0.70 |
| 9 |
0.55 |
1.10 |
0.90 |
| 10 |
0.55 |
1.10 |
0.90 |
| 14 |
0.55 |
1.10 |
0.90 |
(1) 体系中发生反应的化学方程式是____________;
(2) 计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3) 该反应达到平衡时反应物X的转化率α等于________;
(4) 如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1所对应的实验条件改变是:______ ______。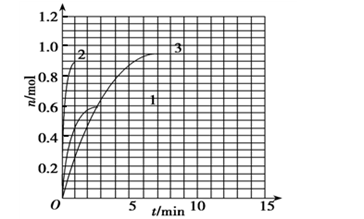
(5)如果起始加入X、Y、Z的物质的量分别为2.00 mol、4.00 mol和0 mol,在原温度下达平衡时,X的转化率为α!,则α! α(填 < > =)。
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00 mol、1.00 mol和1.00 mol,此时可逆反应的反应速率:u(正)u(逆)(填 < > =)。