氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(用a、b 表示)。 (2)负极反应式为 。
(2)负极反应式为 。
与氖原子核外电子数相同的四原子分子的化学式是,与氖原子核外电子数相同的五原子分子的结构式是,与氩原子核外电子数相同的四原子分子,既含极性键又含非极性键,它的电子式是,与氩原子核外电子数相同的单核离子,其原子核里含17个质子,20个中子,其化学符号是。
某小组对酸化及碱化膨润土负载镍催化CO2加氢甲烷化反应进行了研究。
(1)制备Ni一酸化膨润土、Ni-碱化膨润土的部分流程如下: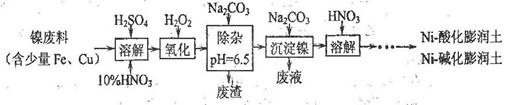
①“溶解”时维持反应温度为70~80℃,其目的是。
②“氧化”一步反应的离子方程式为。
(2)最后一步加HNO3后可回收的主要物质(写化学式)。
(3)在不同温度下,膨润土、Ni-酸化膨润土、Ni-碱化膨润土催化CO2加氢甲烷化反应结果如下图所示: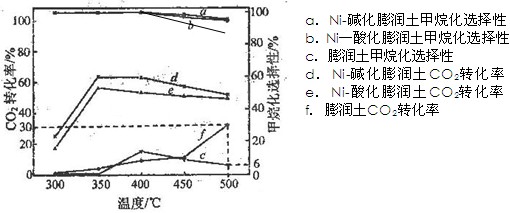
①在测定温度内,Ni-酸化膨润土对CO2加氢甲烷化反应的最适宜温度为350℃,理由是: 。
②500℃时,在上述实验条件下向某装有膨润土的密闭容器中通入5 mol CO2和20 mol H2,充分反应后生成CH4的物质的量为。
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO42-与水反应的方程式:4FeO42-+10H2O 4Fe(OH)3+8OH-+_____。
4Fe(OH)3+8OH-+_____。
K2FeO4在处理水的过程中所起的作用是和。
(2)常温下,Fe(OH)3 的Ksp = 4.0×10-38,请写出Fe(OH)3在水中的溶解平衡方程式
(3)将适量K2FeO4配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是;发生反应的△H 0(填“>”、“<”或“=”)。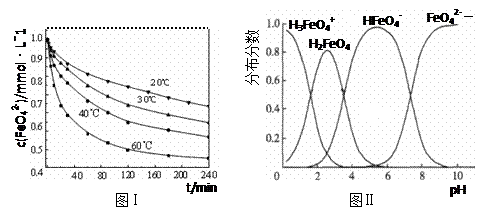
(4)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O
以下由A→G的合成路线叫做“Krohnke反应”: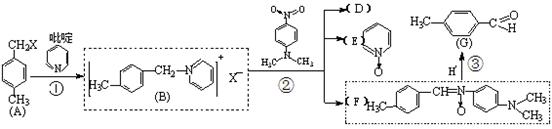
A物质中与苯环相连的“—CH2X”叫做“苄基”。请回答下列问题:
(1)吡啶的分子式为:,用足量的H2还原吡啶,所得的产物的结构简式为
。
(2)A与NaOH水溶液共热,反应方程式为:。
(3)反应②过程: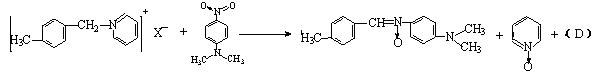
产物中D物质的化学式为;
(4)有关上述过程中的A~G物质,说法正确的是(双选,填序号)
| A.可以用酸性KMnO4溶液区分A和G |
| B.G物质可以命名为3-甲基苯甲醛 |
| C.A→G的合成路线叫做“Krohnke反应在对苄基氧化时保护苯环侧链烃基 |
| D.A和G物质核磁共振氢谱都会产生4种峰 |
(13分)
一定条件下,利胆解痉药“亮菌甲素”跟(CH3)2SO4反应生成A。
二者的结构简式如下图。试回答: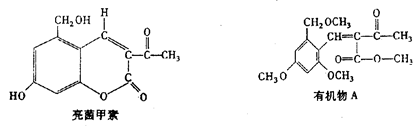
(1)“亮菌甲素”的分子式为_____,1mol“亮菌甲素”跟浓溴水反应时最多消耗____mol Br2;有机物A不能发生的化学反应有_______(填序号)。
①加成反应②酯化反应③水解反应④消去反应
(2)已知: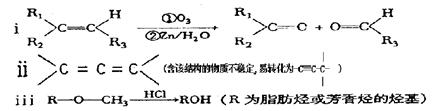
有机物A能发生如下转化: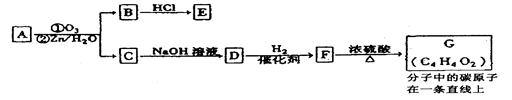
①C→D的化学方程式为____________________________________。
②1mol G跟1mol H2在一定条件下反应,生成物的结构简式为___________。
③符合下列条件E的同分异构体有_____种,写出其中任意一种的结构简式________。
a.遇FeCl3溶液呈紫色; b.不能发生水解反应,但能发生银镜反应;
c.苯环上的一氯取代物只有一种,且分子中无甲基。