(18分)短周期主族元素A、B、C、D、E、F的原子序数依次增大。A的原子半径最小,E是地壳中含量最多的金属元素。C、F同主族,且C原子的最外层电子数是内层电子数的3倍,D原子的核电荷数是B原子的质子数的2倍。请用化学用语回答下列问题:
(1)单质D可在化合物甲中燃烧得单质B和化合物乙。B在周期表中的位置为 ,化合物甲的电子式为 。化合物乙属于 晶体(填晶体类型)。
(2)B、F形成的一种化合物BF2是一种有恶臭的液体,将它滴入硫酸酸化的高锰酸钾溶液中,会有黄色物质析出并放出一种无色无味的气体。写出该反应的离子方程式 。当产生的气体为0.5 mol时,该反应转移的电子数为 。
(3)化合物X、Y、Z依次是B、E、F三种元素最高价含氧酸的钠盐。X、Y溶液均呈碱性,Z溶液pH<7。
①Z的化学式为 。
②Y、Z两溶液混合反应可得到澄清的溶液,该反应的离子方程式为 ;向该溶液中加入X溶液,会产生白色沉淀和无色气体,请写出发生的反应的离子方程式 。
(4)由A、B、C三种元素组成的物质X,其摩尔质量为60g/mol,已知x2 2x,其中X2为X的二聚物,经实验测得不同压强下,体系的平均相对分子质量
2x,其中X2为X的二聚物,经实验测得不同压强下,体系的平均相对分子质量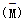 其中随温度T的变化曲线如图所示,
其中随温度T的变化曲线如图所示,
下列说法正确的是 。
A.该过程的△H<0
B.平衡常数:K(a)= K(b)< K(c)
C.气体压强:P(a)< P(b)= P(c)
D.当a=80时,X2(g)与X(g)的物质的量之比为1:1
A~F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性。F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末。这些物质之间满足如图所示的转化关系,图中部分生成物已略去。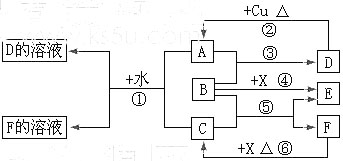
(1)写出下列物质的化学式:A,F。
(2)B的电子式为。根据图中信息,B、C、X的氧化性由强到弱的顺序是(用化学式表示)。
(3)写出反应①的离子方程式;
写出反应⑥的离子方程式。
(4)在反应⑥中,F表现的性质是,当生成0.75 mol C时,被氧化的还原剂的物质的量是。
硫酸被人们誉为“化学工业之母”,在国民生产中发挥着重要作用,硫酸的产量是衡量一个国家化学工业水平的标志。工业上生产硫酸包括三步:
(1)第一步,在沸腾炉中煅烧黄铁矿,反应如下:4FeS2+11O2 8SO2+2Fe2O3,该反应的氧化产物是,当生成8 mol SO2时转移电子的物质的量为。
8SO2+2Fe2O3,该反应的氧化产物是,当生成8 mol SO2时转移电子的物质的量为。
(2)第二步,在接触室中发生如下反应:2SO2+O2  2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1α2(填“大于”、“等于”或“小于”)。
2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1α2(填“大于”、“等于”或“小于”)。
(3)第三步,在吸收塔中将SO3转化成硫酸。硫酸是化学实验中的常用试剂:
①浓硫酸可以与多种物质发生化学反应,试写出浓硫酸与铜发生反应的化学方程式。
②有Na、Mg、Al、Cu四种金属,若两两混合后取混合物14 g与足量稀硫酸反应,产生标准状况下H25.6 L,则此混和物的组合方式最多有种。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。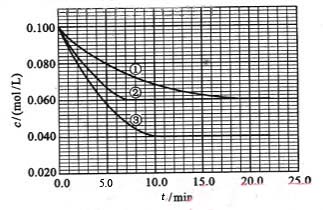
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件是:②_______________;③_______________。
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________。
(3)该反应的正反应是(填“放热”或“吸热”)反应。
(4)实验③前10.0 min内平均反应速度率vB=__________________。
D、E、X、Y、Z是短周期元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)D和X形成的化合物中的化学键类型是_______________;D和Y形成的分子是_________(填“极性”或“非极性”)分子。
(2)Y和Z的简单离子的半径大小为__________(用离子符号和“>”、“=”或“<”表示)。
(3)比较元素非金属性的强弱有很多方法,关于D和X的非金属性强弱的研究方案中不可行的是_________(填序号)。
①比较氢化物的稳定性②依据两元素在周期表的位置③比较两种单质的颜色
④比较单质与H2化合的难易程度⑤比较最高价氧化物对应水化物的酸性
(4)当满足一定比例时,Z的单质可与E的最简单氢化物反应生成一种盐和另一种单质,试写出该反应的化学方程式________________________。
(5)写出下列反应的化学方程式:
①工业上用D的单质制X的单质___________________________________;
②E的最高价含氧酸的浓溶液与单质D反应__________________________。
(6)E有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则生成的E的含氧酸盐的化学式是__________。
A、B、C、D、E五种元素均是短周期的主族元素,原子序数依次增大。B、E原子的最外层电子数均为其电子层数的两倍,D、E元素原子的最外层电子数相等。X、Y、Z、W均由上述元素的两种元素组成,甲、乙均由上述元素的三种元素组成。元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)。转化关系如图(反应条件略去)。请回答下列问题:
(1)X、Y、Z、W属于同一类物质,这类化合物可称为;X、Y、W都能与Z反应,则Z为(写化学式)。
(2)写出M与甲的浓溶液、M与乙的浓溶液加热时反应的化学方程式:
①;②。
(3)化合物BE2与化合物Y结构相似,则BE2的电子式为。
(4)上述六种化合物中是空气质量日报必须分析测定的物质,他们的危害是。(写一种及对应危害即可)
(5)将X、W与D按1:1:n通入Z中,充分反应后无气体剩余或生成,写出反应的化学方程式。