研究碳、氮氧化物的性质与利用具有重要意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是 。
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为 ;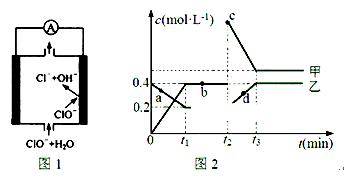
(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是 ;
②图中a、b、c、d四点中,表示反应处于平衡状态的是 。t1~t2时间内v正(乙) v逆(甲)(填“>”“<”或“=”)
③反应进行到t2时刻,改变的条件可能是 。
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
常温下,将一元酸HA(甲、乙、丙、丁代表不同浓度的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 |
HA的物质的量浓度/mol·L-1 |
NaOH物质的量浓度/mol·L-1 |
混合后溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?_______________。
(2)乙组混合溶液中离子的浓度c(A-)和c(Na+)的大小关系是________。
A.前者大B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度大小顺序为________。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=________mol·L-1。
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1 km,压强增大约25 000~30 000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)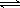 SiF4(g)+2H2O(g) ΔH=-148.9 kJ·mol-1
SiF4(g)+2H2O(g) ΔH=-148.9 kJ·mol-1
根据题意完成下列填空:
(1)在地壳深处容易有________气体逸出,在地壳浅处容易有________沉积。
(2)如果上述反应的平衡常数K值变大,该反应________(选填编号)。
a.一定向正反应方向移动
b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动
d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,________(选填编号)。
a.2v正(HF)=v逆(H2O)
b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变
d.反应物不再转化为生成物
(4)若反应的容器容积为2.0 L,反应时间8.0 min,容器内气体的密度增大了0.12 g·L-1,在这段时间内HF的平均反应速率为________。
现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水。
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是________(填序号);
(2)④、⑤、⑥、⑦五种溶液中NH4+浓度由大到小的顺序是________(填序号);
(3)将③和④按体积比1∶2混合后显碱性,混合液中各离子浓度由大到小的顺序是________。
(4)已知t ℃,Kw=1×10-13,则t ℃________25 ℃(填“>”或“<”或“=”)。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________________。
某学生利用图所示实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。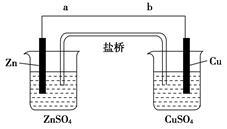
按照实验步骤依次回答下列问题:
(1)导线中电子流向为____________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式:____________________________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________;(不许用“NA”表示)
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的________(填序号)。
A.NaOHB.Zn
C.Fe D.H2SO4
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。已知:
①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)ΔH1=+156.6 kJ·mol-1
②CH3CH===CH2(g)→CH4(g)+HC≡CH(g)ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH===CH2(g)+H2(g)的ΔH=________kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为________________;放电时,CO32-移向电池的________(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3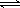 HCO3-+H+的平衡常数K1=________(已知:10-5.60=2.5×10-6)。
HCO3-+H+的平衡常数K1=________(已知:10-5.60=2.5×10-6)。