元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。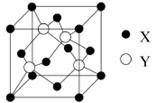
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
根据图示回答下列问题:
(1)写出A、E、G的结构简式:A___________,E_________,G___________;
(2)反应②的化学方程式(包括反应条件)是:_____________________
反应④化学方程式(包括反应条件)是:__________________________________;
(3)写出①、⑤的反应类型:①________________、⑤______________。
则能表示甲醇燃烧的热化学方程式为__________________。
(10分)下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。请填写以下空白:
(1)A的化学式B的电子式。
(2)写出下列反应的化学方程式:
D+G→ H,
F+J → B + C + I。
(3)写出A+NaOH→D的离子方程式。
已知2X2(g)+Y2(g)  2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
⑴此反应平衡常数表达式为_____________;若将温度降低到300℃,则反应平衡常数将_____(填增大、减少或不变)。
⑵若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度_______Wmol·L—1(填“>”、“<”或“=”),a、b、c之间满足关系___________(用代数式表示)。
⑶能说明反应已达平衡状态的是___________________。
| A.浓度c(Z)=2c(Y2) | B.容器内压强保持不变 |
| C.v逆(X2)=2v正(Y2) | D.容器内的密度保持不变 |
⑷若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1mol Y2达到平衡后,Y2的转化率将_____(填“变大”、“变小”或“不变”)。
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
KIO3+KI+H2SO4====K2SO4+I2+H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是。
(3)已知:I2+2S2O32-====2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b. 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c. 以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg。
已知:①双键在链端的烯烃发生硼氢化-氧化反应,生成的醇羟基在链端: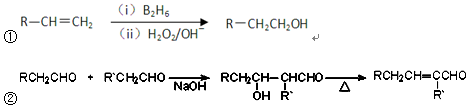
化合物M是一种香料,可用如下路线合成: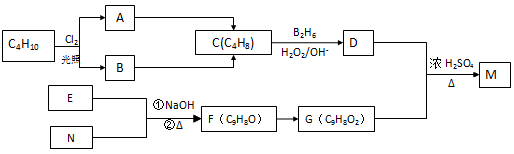
已知:核磁共振氢谱显示E分子中有两种氢原子,F为芳香族化合物。请回答下列问题:
(1)原料C4H10的名称是(用系统命名法);
(2)写出反应A→C的反应条件:;
(3)F与新制Cu(OH)2反应的化学方程式;
(4)写出N、M的结构简式、;
(5)写出与G具有相同官能团的G的所有芳香类同分异构体(不包括G本身)的结构简式: