(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)除去KNO3溶液中的I2杂质,主要操作步骤是:加CCl4后,振荡,静置, 。水溶液最终从分液漏斗的 分离出来
(3)黑火药是中国的“四大发明”之一。黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S=K2S+2NO2↑+CO2↑。其中被氧化的元素是 ,氧化剂是 ,生成1molCO2时转移的电子数目为(NA表示阿伏伽德罗常数的值)
A、B、C、D、E五种元素原子序数逐渐增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。回答下列问题:
(1)AB(用元素符号表示)
(2)D的最高价氧化物对应水化物的化学式为。
(3)C与E组成的常见化合物的电子式为。
将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
①取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
②另取50.0mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
③再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,得到一种无色气体,其体积换算成标准状况时为0.448 L;
请根据以上实验中得到的数据分析计算:
⑴原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
⑵所得混合溶液中c(Cu2+)的取值范围;
⑶若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉
或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
物质A-H有下图所示转化关系(有些产物没有列出)。其中,B是一种极易溶于水的气体,D是能使湿润的淀粉KI试纸变蓝的物质,G是难溶于水的蓝色固体。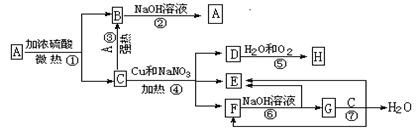
试填写下列空白:
(1)写出Cu与H的浓溶液反应的化学方程式:;
(2)写出反应④的离子方程式:;
(3)用电子式表示A和B的形成过程:、;
(4)用惰性电极电解F的水溶液时,两极的电极反应式为:
正极;
负极。
某溶液中可能含有Na+、K+、Mg2+、I—、SO32—、SO42—等离子中的全部或其中的几种。现分别进行以下实验操作:
①用洁净的铂丝蘸取溶液在无色火焰上灼烧,焰色呈黄色;②取原溶液,滴加少量溴水,振荡后溶液仍为无色。③取原溶液,加入盐酸酸化的Ba(NO3)2溶液后,产生白色沉淀。
(1)原溶液中一定存在的离子是,一定不存在的离子是。
(2)上述①~③,的操作中,是错误的,应改为,以便确定离子的存在。
(3)为确定离子是否存在,应补充的实验是①
②。
某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。其结构简式如下:
已知:①在一定条件下,羧酸酯或羧酸与含—NH2的化合物反应可以生成酰胺,如:

②酯比酰胺容易水解。
请填写下列空白:
(1)在稀酸条件下加热,化合物A首先生成的水解产物是_________和___________
(2)在较浓酸和长时间加热条件下,化合物A可以水解生成:_________、_________和___________
(3)化合物A分子内的官能团之间也可以发生反应,再生成一个酰胺键,产物是甲醇和________(填写结构简式,该分子中除苯环以外,还含有一个6原子组成的环。)