[化学——选修2:化学与技术](15分)利用生产磷铵[(NH4)3P04]排放的废渣磷灰石[(Ca3(P04)2)]制取硫酸并联产水泥的工艺流程如下:
(1)操作a的名称 ,实验室中进行此操作时用到的玻璃仪器有 。
(2)在实验室中操作b包括____、冷却结晶。
(3)干燥机中发生反应的化学方程式为 。
(4)水泥常用做建筑材料,是利用了水泥的 性质。
(5)SO2的催化氧化反应为2SO2(g)十02(g)  2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
①实际生产中,S02的催化氧化反应是在常压、400 ℃ —500 ℃ 条件下进行。采用常压的主要原因是 ;该反应化学平衡常数大小关系是:K(400 ℃ ) K(500 ℃)(填“>”、“<”或“="”" )。
②催化氧化时使用热交换器的原因是 。
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾。下列能用于测定硫酸尾气中SO2含量的试剂组是 。(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2C03溶液、酚酞试液
c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸
回答下列各小题:
(1)已知NaHSO4在水中的电离方程式为 NaHSO4= Na+ + H+ + SO42- 。在NaHSO4溶液中c(H+)c(OH-)+ c(SO42-)(填 “>”、“=”或“<”)。
(2)常温下,向1.0mol / L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。
其中b点所示溶液呈(填“酸性”、“中性”或“碱性”),c点所示的离子方程式为。
(3)在t℃时,将NaHSO4晶体加入到pHH= 6的蒸馏水中,保持温度不变,测得溶液的pHH为2。t℃将25℃(填“高于”或“低于”),Kw=,在该溶液中由水电离出的c(H+)为mol / L。t℃时,将pH =11的NaOH溶液V1L与pH =1的H2SO4溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1∶V2 =,此溶液中各种离子的浓度由大到小的排列顺序为。
(4)在0.1mol / L的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4HSO4溶液、④NH4Cl溶液中,c (NH4+)由大到小的排列顺序为。(用序号填空)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值_______________(填“一定增大”“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O (g) CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
CO和H2O物质的量浓度变化如下图(a)所示,则:
① 0-4min间平均反应速率v(CO)=________ mol•L-1•min-1
②在800℃时该反应的化学平衡常数K=___________________________(要求写出表达式及数值);CO的转化率=______________。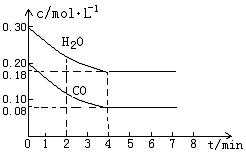
图(a)
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol/L和0.80 mol/L,则达到平衡时CO转化为CO2的转化率是:______________________。
(3)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是_______
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比, c(Mg2+)后者大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,则溶液的pH=9
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOHB. NH3·H2O C. CuOD. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示: lg5 =0.7)
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化: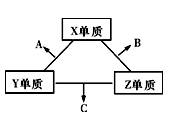
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。
请回答下列问题:
(1)X元素在周期表中的位置是
(2)①C在一定条件下反应生成A的化学方程式是
②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式)
下图表示几种无机物之间的转化关系,其中A、B均为黑色粉末,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色。
请回答下列问题:
(1)A的化学式是 ,C的电子式是 ,Y的名称是 。
(2)反应①的化学方程式为 。
(3)实验室测定气体E的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示) 。
(4)19.2g的D与足量的一定浓度X的溶液反应,将所得的气体与 L O2(标准状况下)混合,恰好能被水完全吸收。