有甲、乙、丙三种物质:
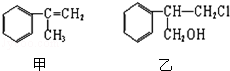
(1)关于乙下列叙述正确的是
a.1mol该有机物在加热和催化剂作用下,最多能和2mol NaOH反应
b.该有机物能使酸性KMnO4溶液褪色
c.该有机物的分子式为C9H11Cl
d.该有机物在一定条件下,能发生消去反应、取代反应、氧化反应和还原反应
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
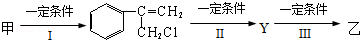
①反应Ⅰ的反应条件是
②其中反应II的化学方程式是
(3)由甲出发合成丙的路线之一如下:

①写出反应②的化学方程式
②写出C与丙的结构简式 、
(本小题15分)A、B、C、D四元素的核电荷数依次增加,它们的离子的电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半。回答以下问题:
(1)四元素的符号依次是A______;B______;C________;D______。
(2)写出B、D元素的离子结构示意图:
B.______________________; D.______________________。
(3)用电子式表示A、C元素形成的离子化合物的过程:
________________________________________________________。
(4)在A、B、C、D最高价氧化物水化物中:
比较其中酸的酸性强弱:____________________________;
比较其中碱的碱性强弱:____________________________。
分别用A、B、C、D四块金属片做如图所示实验,实验数据如下:
| 金属片 |
电子流动方向 |
电压表读数 |
| A |
Cu←A |
+0.67 |
| B |
Cu→B |
-0.71 |
| C |
Cu←C |
+1.35 |
| D |
Cu←D |
+0.30 |
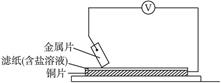
已知:构成两电极的金属活动性相差越大,电压表读数越大。请依据表中数据判断:
(1)_________金属可能是最强的还原剂。
(2)_________金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是_________(填字母)。金属对应的原电池的电极反应为:负极: _________,正极: _________。
A、B、C是大家熟悉的与生命运动密切相关的三种化合物,B是能造成温室效应的气体,它们所含元素不超过三种,并有如下图所示的转化关系。
回答以下问题:
(1)在A、B、C、D四种化合物中,所含元素种类完全相同的是(写字母代码和物质名称)_____________。
(2)在常温下,A和B通过_____________途径转化为C。
(3)目前,化合物B在自然界中的含量呈上升趋势,对于环境产生了不良影响,发生这种变化的主要原因是_____________。
氮化硅是一种高温陶瓷材料,结构类似于硅、二氧化硅,它的硬度大,熔点高,化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1 300 ℃反应制得。
(1)根据性质,推测氮化硅的用途是()
| A.制汽轮机叶片 | B.制有色玻璃 |
| C.制永久性模具 | D.制造柴油机 |
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式_______________________________________。
(3)用四氯化硅在氢气中与氮气反应(加强热)可制得较高纯度的氮化硅,反应的化学方程式为_____________________________________________________。
已知钾云母的化学式为K2H4Al6Si6O24。改用氧化物的形式可表示为______________。