现代生活离不开铝,铝有许多优良的性能,因此在各方面有极其广泛的用途。
(1)在高温下,氧化铁粉末发生铝热反应的化学方程式为____________。
(2)某学生拟用铝粉制备少量Al(OH)3,制备过程如下图所示:
请回答:
①通过操作a分离出Al(OH)3,操作a的名称是________。
②从Al(OH)3的性质考虑,用Al2(SO4)3溶液制备Al(OH)3时,常用氨水而不用NaOH溶液,请用
一个化学方程式表明其理由:______________。
(3)铝可以和烧碱溶液反应,该反应的离子方程式为______________。
(4)工业上冶炼的化学方程式为________;若生产2.7t铝,则转移电子的物质的量为_______。
(本题共12分)硫及氯的化合物在生产及生活中有着广泛的应用。
(1)SO2和Cl2均可作漂白剂,但将它们按物质的量1:1通入水中,却没有漂白性,原因是_________(写出反应的离子方程式)。
(2)工业上常用电解法制Cl2,写出反应的化学方程式_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
| A.氨水 | B.稀盐酸 | C.硝酸钾溶液 | D.氯水 |
(4)将22.4L(标准状况)的SO2气体通入1L1 mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______________。
(5)在25 ℃时,向0.1 L 0.002 mol·L-1的NaCl溶液中逐滴加入0.1 L 0.002 mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中继续加入0.1 L 0.002 mol·L-1的NaI溶液,看到的现象是________,产生该现象的原因是_____________(用离子方程式表示)。(已知:25 ℃时Ksp(AgCl)=1.6×10-10,Ksp(AgI)=1.5×10-16)
海洋资源的利用具有广阔前景。
(1)下列不属于海水淡化的方法___________________(填序号)。
A.蒸馏法 B.离子交换法 C.过滤法 D.电渗析法
(2)下图是从海水中提取镁的简单流程。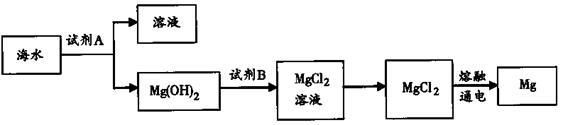
①试剂B是________(填化学式)。
②由无水MgCl2制取Mg的化学方程式是________________________。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示: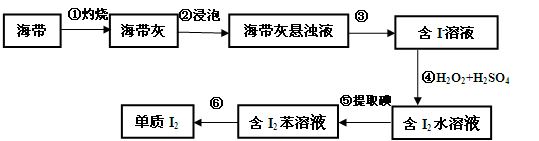
I:下列不属于步骤①操作所用的仪器是 ________(填序号)。
A.酒精灯 B.漏斗C.坩埚 D.泥三角
II:步骤③的实验操作名称是__________。
III:④步骤反应的离子方程式________。
IV:请设计一种检验提取碘后的水溶液中是否含有碘单质的简单方法。
将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题: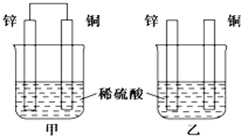
(1)上图两装置中能构成原电池的是(填甲或乙)。
(2)当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子的物质的量为。
(3)现有如下两个反应:A:NaOH+HCl=NaCl+H2O ;B:Fe+2Fe3+= 3Fe2+,根据两反应的本质,判断不能设计成为原电池(填A或B),不能的原因是。
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
①反应的化学方程式为_____________。
②0~10s内,用Z表示的化学反应速率____________。
③X的转化率为________________。
(2)向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:


下列有关说法不正确的是()
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当O2的浓度不变时,反应达到平衡状态 |
| C.当单位时间生成a mol O2,同时生成2a mol SO2时,反应达到平衡状态 |
| D.SO2和O2的转化率相等 |
下表是元素周期表的一部分,根据要求回答下列问题。
| A |
|||||||||||||||||
| E |
F |
J |
H |
||||||||||||||
| B |
D |
I |
G |
||||||||||||||
| C |
K |
||||||||||||||||
(1)元素I位于周期表中的位置。
(2)B、C、D三种元素的最高价氧化物对应的水化物,其中碱性最强的是_______(填化学式)。
(3)H、K、G三种元素对应的氢化物中热稳定性最强的是________(填化学式)。
(4)某离子化合物只含有A、F、J三种元素,该化合物是(填化学式)。
(5)写出D元素最高价氧化物与B元素最高价氧化物对应水化物反应的离子方程______。