(本题共12分)硫及氯的化合物在生产及生活中有着广泛的应用。
(1)SO2和Cl2均可作漂白剂,但将它们按物质的量1:1通入水中,却没有漂白性,原因是_________(写出反应的离子方程式)。
(2)工业上常用电解法制Cl2,写出反应的化学方程式_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
| A.氨水 | B.稀盐酸 | C.硝酸钾溶液 | D.氯水 |
(4)将22.4L(标准状况)的SO2气体通入1L1 mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______________。
(5)在25 ℃时,向0.1 L 0.002 mol·L-1的NaCl溶液中逐滴加入0.1 L 0.002 mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中继续加入0.1 L 0.002 mol·L-1的NaI溶液,看到的现象是________,产生该现象的原因是_____________(用离子方程式表示)。(已知:25 ℃时Ksp(AgCl)=1.6×10-10,Ksp(AgI)=1.5×10-16)
(1)钟乳石和石笋的主要成分是碳酸钙,其形成过程如右图所示。随着旅游人数的增加,潮湿溶洞中的钟乳石和石笋受到二氧化碳侵蚀,其化学方程式为:__________________________________。
(2)某学生提出一个修复溶洞底部受损石笋的研究方案,由以下五步组成,正确的实验步骤依次是__________。
①将盛有碱溶液的容器置于石笋的上部②配制一定浓度的碱溶液③选择合适的碱④调节碱溶液下滴的速度⑤观察石笋表面复原情况
锗是ⅣA族元素,它的单质晶体是一种良好的半导体材料,广泛用于电子工业,锗可以从燃烧的烟道灰中提取,其过程如下: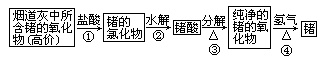
试写出上述过程中①、③、④步反应的化学方程式。
①_________________;
③_________________;
④_________________;
物质A是一种高熔点化合物,不溶于硫酸,硝酸等强酸。A与纯碱熔融反应,生成化合物B,同时放出气体C;把气体C通过B的溶液中,则得到化合物D;D在干燥空气中转变为化合物E;将E加热又得到化合物A。试写出A、B、C、D、E的化学式:A____、B____、C____、D____、E____。
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

 相关信息如下:
相关信息如下:







 a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解; b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物; c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:

 请回答下列问题:
请回答下列问题: (1)写出装置A中发生反应的离子方程式 。
(1)写出装置A中发生反应的离子方程式 。 (2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
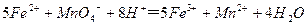
 ①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。 ②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。







(1)下列措施中,有利于降低大气中CO2浓度的有 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
 a.6CO2+6H2O C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
a.6CO2+6H2O C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
 c.CO2+CH4 CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
c.CO2+CH4 CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下: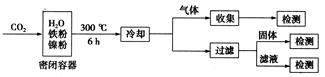
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):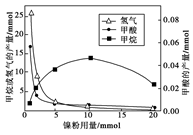
研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即:
 CO2 HCOOH CH4
CO2 HCOOH CH4
①写出产生H2的反应方程式 。 ②由图可知,镍粉是 。(填字母)
②由图可知,镍粉是 。(填字母)
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂
d.不是催化剂







③当镍粉用量从1 mmol增加到10 mmol,反应速率的变化情况是 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率
均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加