松花蛋与明朝初年问世,其腌制配方有多种,但主要配料为生石灰、纯碱和食盐。将一定比例的配料用水和黏土调成糊状,敷于蛋上,密封保存,数日后可食用。
(1)腌制松花蛋的配料用水调制时,主要发生的化学反应的方程式有(不考虑粘土中物质可能参与的反应) 、
。
(2)松花蛋外的糊状物经溶解、过滤后,滤液中肯定含有的溶质为 和 ,可能含有的溶质为Ca(OH)2或Na2CO3。
(3)某同学设计下表的实验方案,探究(2)所得滤液中可能含有的物质是否存在,请你帮他完善实验方案。
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量滤液,滴加适量K2CO3溶液 |
若出现白色沉淀 |
滤液中含Ca(OH)2 |
| 若无白色沉淀 |
滤液中无Ca(OH)2 |
|
| ②取少量滤液, |
若出现 |
滤液中含Na2CO3 |
(4)写出碳酸钠的电离方程式:
已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质;Y在常温下为液态,E的相对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去):
请回答下列问题:
(1)B的化学式为;F与Cu反应的离子方程式为_________;
(2)C可与过量的Cl2反应生成HCl和物质A,A可发生水解反应生成NH3 和HClO,则C与过量Cl2 反应的化学方程式为,反应中的还原剂为;
(3)D气体和CO都是汽车尾气的主要成分,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2D(g) + 2CO(g)  N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
①该反应的化学平衡常数为 K =;
②若保持温度不变,20 min 时再向容器中充入CO、N2
各0.8 mol,平衡将移动(填“向左”、“向右”或“不”)
③20 min时,若改变反应条件,导致CO浓度发生如图
所示的变化,则改变的条件可能是(填序号);
a.缩小容器体积 b.增加CO2的量
c.升高温度 d.加入催化剂
(9分)(1)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率
v (H2)=________________
②分析右图所示图像,下列说法正确的是_________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(2) 加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(3) 在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式、。
(20分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。(1) 在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2) 已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=_____________。
(3) 高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
① 温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
② 1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应是否处于化学平衡状态____________(填“是”或“否”),其判断依据是______
____________________________________________________________。
(4) 如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
① 甲装置中气体A为(填“CH4”或“O2和CO2”),d极上的电极反应式为
_____________________________________。
② 乙装置中a极上的电极反应式为__________________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③ 如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为__________________________(用含w、a的表达式表示,不必化简)。
(1)分子式为 的烯烃有3种同分异构体,
的烯烃有3种同分异构体,
其结构简式分别为  ;和。
;和。
(2)某同学为某烃命名为“1,2—二甲基丙烷”,你认为(填正确或不正确), 若不正确,请写出正确命名(若正确,该空不填)。 请写出该烃的同分异构体中含四个甲基的烃的结构简式。
(3)乙烯是石油裂解的主要产物之一,将乙烯通入溴的四氯化碳溶液中,观察到的现象是;其反应方程式为,乙烯在一定条件下发生加聚反应的化学方程式是,其产物的名称是;乙烯对水果具有功能。
(1)工业上用碳在高温下与二氧化硅反应制取粗硅。反应的化学方程式为:
SiO2+2C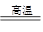 Si+2CO↑,在该反应中氧化剂是_____________________________,被氧化
Si+2CO↑,在该反应中氧化剂是_____________________________,被氧化
的物质与被还原的物质的物质的量之比是____________________________。
(2)请写出铜和稀硝酸反应的化学方程式:,若制得标准状况下的气体 4.48L,则参加反应的硝酸的物质的量为________ mol,转移电子的物质的量为________mol.