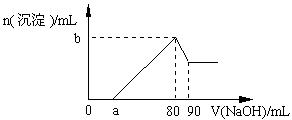
把一块镁铝合金投入到1 mol·L-1盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如右图所示。下列说法中错误的是
| A.盐酸的体积为80 mL |
| B.a的取值范围为0 < a<50 |
| C.n (Mg2+) < 0.025 mol |
| D.当a值为30时,b值为0.01 |
关于下列各装置图的叙述中,正确的是()
| A.若采用装置①精炼铜,则a极为纯铜, b极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应 |
| C.装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸 |
| D.装置④可用于实验室配制一定物质的量浓度的稀硫酸 |
阿伏加德罗常数的值约为6.02×1023,下列说法正确的是()
A.l.8 g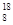 O2分子与1.8 g O2分子与1.8 g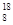 O3分子中含有的中子数不相同 O3分子中含有的中子数不相同 |
| B.标准状况下,22.4LCCl4中共价键数为4NA |
| C.80 mL 10 mol·L–1浓盐酸与足量MnO2反应,转移电子数为0.4×6.02×1023 |
| D.常温常压下,6.02×1023个SO3分子所占的质量约为80 g |
下列实验方案能达到预期目的的是()
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤工业上可用金属铝与V2O5在高温下冶炼V(钒),铝作还原剂
| A.②④⑤ | B.①②⑤ | C.①②④ | D.②③④ |
下列离子方程式正确的是()
| A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全: Ba2++OH- +H+ + SO4 2-= BaSO4↓+H2O |
| B.用石墨作电极电解氯化镁溶液:2Cl- +2H2O=Cl2↑+H2↑+2OH- |
| C.向Ca(OH)2溶液中滴加同浓度的少量Ca(HCO3)2溶液: Ca2+ + HCO-3 + OH-= CaCO3↓ + H2O |
| D.FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O |
既有离子键又有共价键和配位键的化合物是()
| A.NH4NO3 | B.NaOH | C.H2SO4 | D.H2O |