人类利用太阳能已有3000多年的历史,太阳能科技突飞猛进。塑晶学名为新戊二醇(NPG),它和液晶相似,塑晶在恒温44℃时,白天吸收太阳能而贮存热能,晚上则放出白天贮存的热能。已知:NPG的结构式为: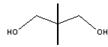 ,有关NPG说法错误的是
,有关NPG说法错误的是
| A.NPG与乙二醇互为同系物 |
| B.NPG可命名为:2,2-二甲基-1,3-丙二醇 |
| C.NPG一定条件下能发生消去反应 |
| D.研究确定NPG的结构,需经重结晶提纯并干燥、元素定量分析确定分子、相对分子质量测定和波谱分析确定结构 |
下列说法正确的是(NA表示阿伏加德罗常数的值)
| A.在常温常压下,11.2 L N2含有的原子数为NA |
| B.32 g O2在标准状况下所占体积约为22.4 L |
| C.标准状况下,18 g H2O所占的体积约为22.4 L |
| D.在同温同压下,相同体积的任何气体单质所含的原子数相同 |
在标准状况下①6.72 L CH4②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
| A.仅abc | B.仅bcd | C.abcd | D.仅acd |
下列叙述正确的是
| A.同温同压下,相同体积的物质,其物质的量必然相等 |
| B.任何条件下,等物质的量的乙烯(C2H4)和一氧化碳所含的分子数必然相等 |
| C.1 L一氧化碳气体一定比1 L氧气的质量小 |
| D.同温同压下,等体积的物质所含的分子数一定相等 |
关于同温、同压下等体积的N2O(气体)和CO2的叙述:①质量相同;②所含碳原子数与氮原子数相等;③所含分子数相等,其中正确的是
| A.①②③ | B.②③ |
| C.①② | D.①③ |
与9.6 g SO2所含的氧原子数相等的NO2的质量为
| A.9.6 g | B.6.9 g |
| C.4.6 g | D.2.3 g |