甲乙两容器中发生相同的反应: A(g) + 3B(g) 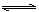 2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
A.体积:甲可能小于乙 B.C的物质的量:甲一定小于乙
C.压强:甲可能大于乙 D.A、C浓度比值c(A)/c(C):甲一定小于乙
现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是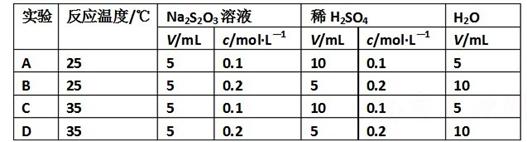
下列有关热化学方程式的叙述,正确的是
| A.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
B.由N2O 4(g)  2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ |
| C.由:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3 kJ |
| D.已知101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则1 mol碳完全燃烧放出的热量大于110.5kJ |
下列图象分别表示有关反应的反应过程与能量变化的关系: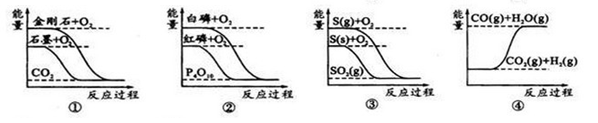
据此判断下列说法正确的是
| A.石墨转变为金刚石是吸热反应 |
| B.白磷比红磷稳定 |
| C.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH>0 |
| D.S(g)+O2(g)=SO2(g) ΔH1; S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2 |
下列有关叙述正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.强电解质溶液的导电能力一定比弱电解质溶液的强 |
| C.SO3溶于水,其水溶液能导电,故SO3是电解质 |
| D.升高温度,可提高活化分子百分数,使有效碰撞增多,化学反应速率加快 |
下列反应中,硝酸既表现酸性,又表现氧化性的是( )。
| A.Fe2O3跟稀硝酸反应 | B.铜跟稀硝酸反应 |
| C.CuO跟稀硝酸反应 | D.Al(OH)3跟稀硝酸反应 |