 图中表示外界条件(t、p)的变化对下列可逆反应的影响:
图中表示外界条件(t、p)的变化对下列可逆反应的影响:
L(s)+G(g) 2R(g);△H>0,y 轴表示的是 ( )
2R(g);△H>0,y 轴表示的是 ( )
| A.平衡时,混合气中G的百分含量 | B.G的转化率 |
| C.平衡时,混合气中R的百分含量 | D.L的转化率 |
已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g);△H=-1025kJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是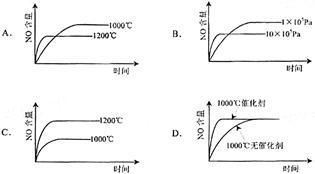
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4υ正(O2)= 5υ逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 |
| D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |
下列说法不符合实验事实的有
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.双氧水溶液中加入氯化铁溶液后没有明显现象 |
| C.红棕色的NO2,用冰水冷却后颜色变浅 |
| D.淀粉碘化钾溶液中加入浓硫酸,一定时间后变蓝 |
下列热化学方程式正确的是(注: 的绝对值均正确)
的绝对值均正确)
| A.C2H5OH(l)+3O2(g)==2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq) ="=" NaCl(aq) + H2O(l);△H= —57.3kJ/mol(中和热) |
| C.S(s) + O2(g) ="=" SO2(g);△H= +269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H= +116.2kJ/mol(反应热) |
升高温度能加快反应速率的主要原因是
| A.活化分子能量明显增加 | B.降低活化分子的能量 |
| C.增加活化分子的百分数 | D.降低反应所需的能量 |