物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)
(1)第一种情况:A为气体;用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:
① B与甲反应的化学方程式为____________________ ___________________。
② D与乙反应的离子方程式为__________________________ _________。
(2)第二种情况:A为黄色固体;甲可由两种单质直接化合得到; D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
① 工业上,反应 I 在___________________(填设备名称)中进行。
② 甲的化学式为______________。
③ D和乙反应的离子方程式为______________________ _________。
④ 请简述检验G溶液中阴离子的方法
⑤ 若A的相对分子质量为M,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数= (列出计算式即可)。
(14分) 电池的发明和应用是化学家们对人类社会的重要贡献之一。
Ⅰ.每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲醇燃料电池的相关技术上获得了新突破,原理如下图1所示。
(1)请写出从C口通入O2发生的电极反应式。
(2)以石墨做电极电解饱和食盐水,如下图2所示。电解开始后在的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为(保留两位有效数字,NA取6.02×1023)。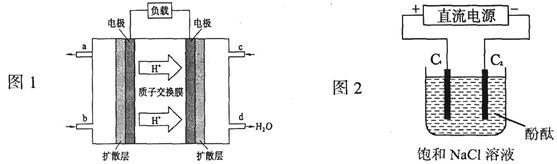
Ⅱ.随着电池使用范围的日益扩大,废旧电池潜在的污染已引起社会各界的广泛关注。
(1)电池生产企业排放的工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。请用离子方程式说明上述除杂的原理。
(2)工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32 mol4·L-4,溶液的pH至少为,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L-1的废水,需用绿矾的质量为kg。(写出主要计算过程)
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等。填写下列空白。
| A |
|||
| B |
C |
D |
(1)写出C的氧化物的一种用途:
(2)B单质与Fe2O3反应时,每消耗13.5g B时放热213kJ,该反应的热化学方程式是
(3)为防止A元素的氧化物AO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:
AO2+X催化剂A2 +H2O+n Z(未配平,n可以为0)。上述反应式中的X不可能是(填标号)。
a.NH3b.COc.CH3CH2OH d.H2O2
(4)A元素的最简单氢化物甲、D元素的最高价氧化物对应的水化物乙都是很重要的基础化工原料。
①一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是(选填序号)。
| 选项 |
a |
b |
c |
d |
| x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
| y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
②25℃时,往a mol·L-1的甲的水溶液中滴加0.01 mol·L-1乙溶液,当两种溶液等体积混合时,溶液呈中性(设温度不变)。滴加过程中溶液的导电能力(填“增强”、“减弱”或“不变”);
所得混合溶液中A、D两种元素的物质的量的关系为:A2D(填“大于”、“等于”或“小于”);甲中溶质的电离平衡常数Kb=(用含a的代数式表示)。
化合物I是工业上用途很广的一种有机物,实验室可以通过下列过程合成:
(1)A是一种气态烷烃,核磁共振氢谱只出现两组峰且峰面积之比为9:1,则A的分子式是______;
C的名称是______;
(2)B→C的反应条件是__________________;
(3)上述过程中属于消去反应的是______;(用字母→字母表示)
(4)H→I的化学方程式是________________________;
(5)G在浓硫酸存在下能生成多种化合物,写出符合下列条件的有机物的结构简式,含有六元环:_____;髙分子化合物:____________。
(6)I有多种同分异构体,其中与I具有相同官能团,不含支链且能发生银镜反应的有______种(不包括I,且不考虑立体异构),写出其中一种的结构简式:______。
氮、磷、锌是与生命活动密不可分的元素。请回答下列问题:
(1)NH3和pH3都是极性分子,其中极性较大的是______,理由是______。
(2)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式是______。
(3)氮化硼(BN)的一种晶体结构与金刚石相似,则B-N-B之间的夹角是____________。氮化砸的密度为3.52g/cm3,则B-N键的键长是______pm (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(4)已知磷酸分子中,P、O原子均满足最外层8个电子的稳定结构,则:
①P与非羟基O之间的共价键的形成方式是____________;
②中和20mL0.1mol/L次磷酸(H3PO2)溶液需要0.1mo/L NaOH溶液的体积恰好为20 mL,则H3PO2的结构式是____________。
(5)Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是________________________
锰锌铁氧体可用于隐形飞机上吸收雷达波涂料。现以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下: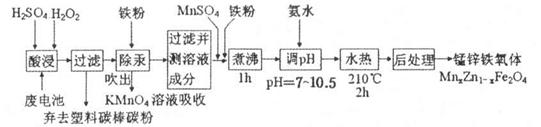
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为_______。
(2)活性铁粉除汞时,铁粉的作用是______ (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液进行吸收而实现的。如下图是KMnO4溶液处于不同pH时对应的Hg去除率变化图,图中物质为Hg与 MnO4-在该pH范围内的主要产物。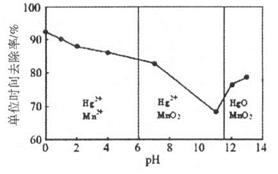
①请根据该图给出pH对汞去除率影响的变化规律:______。
②试猜想在强酸性环境下汞的单位时间去除率高的原因:______。
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该铁氧体组成____________。
(5)经测定滤液成分后同时加入一定量的MnSO4和铁粉的目的是______。