【化学—选修3:物质结构与性质】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料除单晶硅,还有铜铟镓硒等化合物。
(1)镓的基态原子的电子排布式是_____________。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为______用元素符号表示)。
(3)气态SeO3分子的立体构型为______________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________________________________________。
(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为________。
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应生成铜氨配离子的溶液,则该反应的离子方程式为____________________。
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
【化学—选修2:有机化学基础】水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是_____________(填两种物质的名称),其净水作用的原理是_________________________。
(2)水的净化与软化的区别是____________________________________。
(3)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_______________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2_________g,后加入Na2CO3___________g。
(5)如图是电渗析法淡化海水的原理图。其中,电极A接直流电源的正极,电极B接直流电源的负极。
①隔膜A是_________离子交换膜(填“阴”或“阳”)。
②某种海水样品,经分析含有大量的Na+,Cl-,以及少量的K+,SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A,B,C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为____________。
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气作为能源最大的优点是燃烧产物是水,无污染。请你再列举一条氢气作为能源的优点:_____________________________________________。
(2)LiAlH4是一种重要的储氢载体,能与水反应得到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为_______________________________________。
(3)氮化锂(Li3N)是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为;Li3N+2H2 LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=__________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为__________。(用A、D表示)
②生成目标产物的电极反应式为_______________________________。
③该储氢装置的电流效率η=_________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料。CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。
请回答下列问题:
(1)B点时剩余固体的化学式是____________。
(2)加热至A点时反应的化学方程式为______________________________。
(3)CrO3具有两性,写出CrO3溶解予KOH溶液的反应化学方程式____________________。
(4)三氧化铬还用于交警的酒精测试仪,以检查司机是否酒后驾车。若反应后红色的CrO3变为绿色的Cr2(SO4)3,酒精被完全氧化为CO2,则其离子方程式为_______________。
(5)由于CrO3和K2Cr2O7均易溶于水,所以电镀废水的排放是造成铬污染的主要原因。某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图:
①A为电源___________极,阳极区溶液中发生的氧化还原反应为________________________。
②已知电解后阳极区溶液中c(Fe3+)为2.0×10-13 mol·L-1,则c(Cr3+)为__________mol·L-1。{已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
镁橄榄石主要成分是Mg2SiO4,电解法促进镁橄榄石固定CO2的工艺流程如下图所示:
已知:Mg2SiO4(s)+4HCl(aq) 2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
固碳时主要反应的方程式为NaOH(aq)+CO2(g)=NaHCO3(aq)。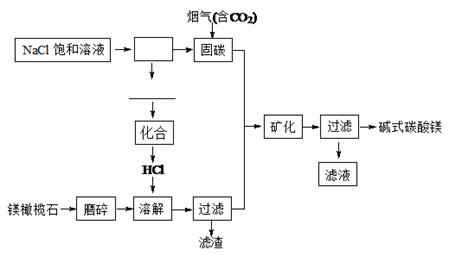
(1)上图方框里的操作名称是,横线上的物质有(填化学式)。
(2)下列物质中也可用作“固碳”的是(填字母序号)。
| A.CaCl2 | B.NH3·H2O |
| C.Na2CO3 | D.H2O |
(3)由下图可知,90 ℃后曲线A溶解效率下降,分析其原因。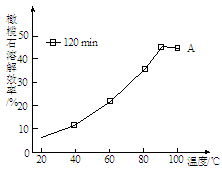
(4)经分析,所得碱式碳酸镁沉淀中含有少量NaCl。为提纯,可采取的方法是。本流程中可循环利用的物质是(填化学式)。
(5)另一种橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为。