A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:
(1)B和C均为有支链`的有机化合物,B的结构式为 ;
C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为 。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为
(3)写出⑤的化学反应方程式 。
⑨的化学反应方程式 。
(4)①的反应类型 ,④的反应类型 ,⑦的反应类型 。
(5)与H具有相同官能团的H的同分异构体的结构简式为 ________ 。
已知硝酸与金属反应时,在不同条件下有不同的还原产物,甚至在同一反应中可同时得到多种还原产物。现有HNO3、NH4NO3、N2O、H2O、Zn、Zn(NO3)2六种物质,(1)请利用其中五种物质组成一个完整的化学反应,写出该化学反应方程式;
(2)上述所写反应中,硝酸表现出的化学性质是,被还原的元素是。
(3)若六种物质组成一个完整的化学反应,则反应中的还原产物是(填化学式),若该反应中NH4NO3与N2O物质的量之比为1︰1,那么该反应中氧化剂与还原剂的物质的量之比为。
一定温度下,将2mol A和2mol B两种气体混合于体积为2 L的某恒容的密闭容器中,发生如下反应:3A(g)+B(g) x C(g)+2D(g),
x C(g)+2D(g), H <0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
H <0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)X的值等于,
(2)该反应的化学平衡常数K=,升高温度时K值将
(填“增大”、“减小”、“不变”)
(3)A物质的转化率为。
(4)若维持温度不变,在原平衡混合物的容器中再充入3mol C和3mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为mol;达新平衡时,A的物质的量为n(A)= mol。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为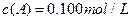 、
、 及
及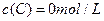 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②____________;
③_______________;
(2)实验②平衡时B的转化率为________;实验③平衡时C的浓度为__________;
(3)该反应的 _______0,判断其理由是________________________________;
_______0,判断其理由是________________________________;
(4)该反应进行到4.0min时的平均反应速率:
实验②: =_______________________;实验③:
=_______________________;实验③: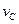 =____________________。
=____________________。
某同学用中和滴定法测定某烧碱样品的纯度,其操作步骤如下:
①称取25.0g烧碱样品,配成1L溶液;
②用(填仪器名称)量取10.00mL配制好的溶液于锥形瓶中,用0.20mol·L-1的标准盐酸滴定(杂质不与盐酸反应),所得数据如下表,其中第2组数据读数如图所示。
| 滴定序 号 |
待测液体积/mL |
所消耗盐酸标准液的体积/mL |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
V |
0.50 |
25.52 |
25.02 |
| 2 |
V |
|||
| 3 |
V |
1.00 |
25.98 |
24.98 |
请回答下列问题:
(1)根据滴定管的读数填写上表。
(2)实验过程中,配制溶液定容时俯视刻度线会使所配溶液浓度(填“偏大”“偏小”或“无影响”,下同);滴定前仰视液面,滴定后平视液面会使烧碱样品纯度的测量值比实际值。
(3)三组数据中,因误差过大而应舍去的一组是第组(填序号),根据合理数据求得该烧碱样品中NaOH的质量分数为。
有浓度均为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1) 三种溶液中c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为_____。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量
依次为n 1mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小顺序为____________。
(4)等体积的上述三种酸与足量的锌反应,产生氢气的体积(相同条件下)分别为V1L、V2L、V3L,其大小顺序为____________。