【化学—物质结构与性质】
第四周期的Cr 、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:
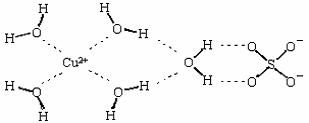
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
氧化还原反应是重要的一类化学反应。
(1)在化学反应2KMnO4 + 10KI + 8H2SO4=6K2SO4+ 2MnSO4 + 5I2 + 8H2O中,化合价降低的元素是 ,发生氧化反应的物质是。
(2)据反应8NH3 + 3Cl2=6NH4Cl + N2回答下列问题:
①该反应中,氧化剂是 ,还原剂是。
②该反应中,当有8mol NH3反应时,转移电子总量是mol。
③参加反应的氧化剂与还原剂的物质的量之比为 (最简整数比)。
④当有3mol e- 转移时,该反应生成的氧化产物的质量是g。
铁是人类较早使用的金属之一,根据所学铁及其化合物的知识,回答下列问题:
(1)下列各物质中,不能和单质铝反应的物质是(填下列各项序号)。
①Fe②FeCl3③FeSO4
(2)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,实验得到的分散系
属于(填“溶液”“浊液”或“胶体”),所得到的分散系中的分散质具有的性质有如下的(填写序号)。
①电泳②透过半透膜③聚沉④具有强还原性
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的化学方程式:;证明反应后的溶液中存在Fe3+的实验方法是。
现有下列六种物质,请根据要求填空(填写序号):
①氢氧化钠②氯化镁 ③二氧化碳 ④稀氨水 ⑤氢氧化铁胶体
(1)属于电解质的是
(2)属于混合物的是
(3)属于酸性氧化物的是
(10分)如图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹;x、y分别为直流电源的两极。在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入一多孔的惰性电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,生成气体如图所示。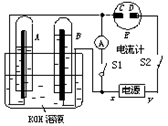
请回答下列问题:
(1)标出电源的正、负极:x为 。
(2)在滤纸的C端附近,观察到的现象是 。
(3)写出电极反应式:B电极 。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断开关S2闭合开关S1,则电流计的指针是否发生偏转 (填“偏转”或“不偏转”)。
(5)若电流计指针偏转,写出有关的电极反应(若指针“不偏转”,此题不必回答。);
。
若电流计指针不偏转,请说明理由(若指针“偏转”,此题不必回答) 。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 |
操作 |
实验现象 |
| ① |
分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 |
试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② |
另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 |
试管A、B中均未明显见到有 气泡产生。 |
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_________________________________(用实验中所提供的几种试剂)。
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: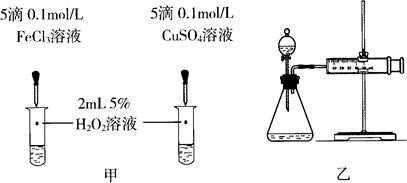
①定性分析:如图甲可通过观察_________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_________________________。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_________________________。