利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知: SO2(g) +1/2O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时
v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
 (4)若以右图所示装置,用电化学原理生产硫酸,写
(4)若以右图所示装置,用电化学原理生产硫酸,写
出通入O2电极的电极反应式为 。
下图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一。 A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质。
试回答下列问题:
(1)写出B的化学式:,写出A的电子式;
(2)写出I→K的离子方程式;
(3)写出F与Fe3O4在高温下反应的化学方程式;
(4)已知3g J完全燃烧放出a kJ的热量,请写出表示J的燃烧热的热化学方程式:
。
以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如下: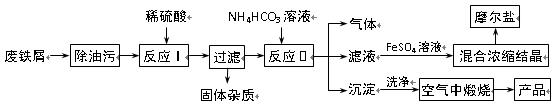 已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液。
已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液。


请回答下列问题:
(1)用5%的Na2CO3热溶液去油污(主要成分是油脂)时,反应生成的有机产物是(写名称):。
(2)反应Ⅰ需要控制在50℃~80℃以提高反应速率,如果硫酸过量,反应混合液与空气接触会发生副反应,如何检验副反应的产物?
。
(3)写出在空气中煅烧沉淀的化学反应方程式:。
(4)本流程中产生的CO2和H2,在催化剂作用下按体积比1∶1合成一种重要的有机化工原料R,该合成符合绿色化学要求。上述合成反应∆H=+14.9kJ/mol,则加压、降温可以使平衡分别向、方向移动。已知液体R的燃烧热为254.6kJ/mol,则R完全燃烧的热化学方程式为。
(5)摩尔盐常用于定量分析并用于医药、电镀方面。已知摩尔盐中结晶水的含量为27.6%,n(Fe2+)∶n(SO2-4)=1∶2,则摩尔盐的化学式中,结晶水数目x的计算式为:
x=。
烃A的相对分子质量为42,B与新制的Cu(OH)2加热至沸腾产生红色沉淀,E可作隐形眼镜材料。下列各物质的转化关系如下图所示:


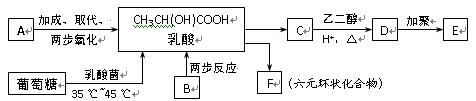
已知: ,请回答下列问题:
,请回答下列问题:
(1)多羟基醛、多羟基酮以及水解能生成它们的有机物都属于糖类,写出乳酸的同分异
构体中,属于糖的一种有机物的结构简式。
(2)写出以下物质的结构简式:A,E,F。
(3)B的名称是,由B合成乳酸的第一步反应属于反应。
(4)由A合成乳酸的第二步反应化学方程式是(自选合适的无机试剂):
;
(5)C转化为D的化学方程式是。
用A~M分别代表一种物质,它们之间的转化关系如下图所示(部分生成物略去)。其中A为紫色晶体,B、H、J均为常见的单质气体,单质E在浓硝酸中钝化。
请回答下列问题: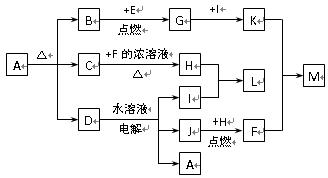
(1)D的化学式是,L由3种元素组成,其电子式是。
(2)E元素在周期表中的位置是。工业上可利用C与E在高温下反应冶炼金属,该反应的化学方程式是。
(3)用C与F溶液制H气体时,发生反应的化学方程式是。
(4)用石墨电极电解D的水溶液时,阳极的电极反应式是。
(5)在500mL0.2mol/LK物质的水溶液中逐滴加入F的水溶液并不断搅拌,溶液中析出沉淀的质量发生变化,在右图中画出沉淀质量随加入F的物质的量的变化曲线。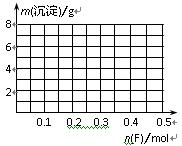
簸箩酯是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸 -O-CH2-COOH发生酯化反应的产物。
-O-CH2-COOH发生酯化反应的产物。
(1)甲一定含有的官能团的名称是_________。
(2)5.8g甲完全燃烧可产生0.3molCO2和0.3molH2O,甲蒸气对氢气的相对密度是29,甲
分子中不含甲基,且为链状结构,其结构简式是______________________。
(3)苯氧乙酸有多种类型的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝
基取代物的同分异构体是(写出任意2种的结构简式)___________ _____________。
(4)已知:
簸箩酯的合成线路如下:
①及时X不可选用的是(选填字母)__________。
a.CH3COONa溶液 b.NaOH溶液 c.NaHCO3溶液 d.Na
②丙的结构简式是______________,反应Ⅱ的反应类型是_____________________。
③反应Ⅳ的化学方程式是_________________________________________________。