下列电解质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH;⑤BaSO4;⑥AgCl;⑦Na2O;⑧K2O;⑨H2O,________________是强电解质;______________是弱电解质
Ⅰ.Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。 请回答下列问题:
请回答下列问题: (1)电池的负极材料为,电解液中Li+的移动方向是由极到
(1)电池的负极材料为,电解液中Li+的移动方向是由极到
极(填“正”或“负”)。 (2)电池正极发生的电极反应为。
(2)电池正极发生的电极反应为。 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为。
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为。 (4)组装该电池必须在无水、无氧的条件下进行,原因是
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
Ⅱ.某地区的酸雨情况严重,钢铁锈蚀非常明显,其腐蚀属于电化学腐蚀中的______腐蚀;右图为该地区钢铁腐蚀原理的简图,正极的电极反应式为。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请画出修改后的简单示意图,并标出电子流动方向。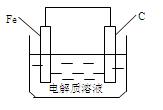
已知 :N2(g)+3H2(g)  2NH3(g)ΔH=-92 kJ·mol-1。
2NH3(g)ΔH=-92 kJ·mol-1。
(1) 在500℃、2.02×107Pa和铁催化条件下2L密闭容器中充入1molN2和3mol H2,10 min时达到平衡,有0.2 mol NH3生成,则10 min内用氢气表示的该反应的平均速率v(H2)为,H2的转化率为__________。
(2)充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是 。
。
(3)为有效提高氢气的转化率,实际生产中宜采取的措施有____________
| A.降低温度 | B.不断补充氮气 | C.恒容下充入He来增大压强 |
| D.升高温度 E.原料气不断循环 F.及时移出氨 |
(4)氨催化氧化制NO在热的铂铑(Pt-Rh)合金催化下进行,反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为________________,当升高温度时,K值______(填“增大”、“减小”、“不变”)。NH3转化率在温度T1下随反应时间(t)的变化如右图:其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下NH3转化率随反应时间变化的预期结果示意图。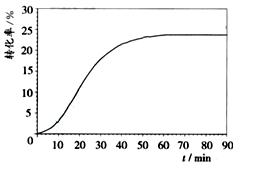
Ⅰ.某探究小组用HNO3与大理石反应过程中固体质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石 质量/g |
规格 |
HNO3浓度/mol·L-1 |
HNO3 体积/ mL |
实验目的 |
| ① |
298 |
10.00 |
粗 |
1.00 |
25.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和探究温度对该反应速率的影响; (Ⅲ)实验①和探究大理石规格(粗、细)对该反应速率的影响。 |
Ⅱ.某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现红色。一位同学由此得出该催化剂中铁元素价态为+3的结论。
(1)请指出该结论是否合理,并说明理由。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;3mol/L H2SO4、3%H2O2、6mol/L HNO3、0.01mol/L KMnO4、NaOH稀溶液、0.1mol/L KI、20%KSCN、蒸馏水。
① 提出合理假设
假设1:;
假设2:;
假设3:。
② 基于上述假设,设计实验方案。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1 |
|
| 步骤2 |
|
| 步骤3 |
|
| …… |
13发展煤的液化技术被纳入 “十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目近日已获批复。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇,从而实现液化。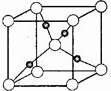

(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式 。
(3)右图是铜的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是 。 (5)煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛,
(5)煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛, 甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 ; 1mol甲醛分子中σ键的数目为 。
甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 ; 1mol甲醛分子中σ键的数目为 。
已知:①双键在链端的烯烃发生硼氢化-氧化反应,生成的醇羟基在链端: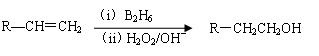
②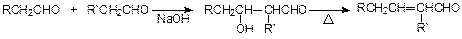
化合物M是一种香料,可用如下路线合成: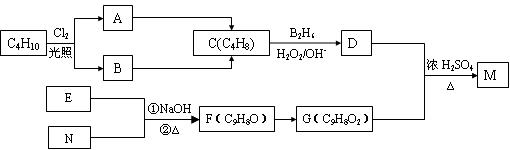
已知:核磁共振氢谱显示E分子中有两种氢原子。F为芳香化合物。
请回答下列问题:
(1)原料C4H10的名称是__________(系统命名);
(2)写出反应A→C的反应条件:__________;
(3)D也可由C与水蒸气在一定条件下合成。这种制法与题给反应条件相比,缺点是_____________________________;
(4)F与新制Cu(OH)2反应的化学方程式__________________________;
(5)写出E、N、M的结构简式____________、____________、______________;
(6)写出与G具有相同官能团的G的所有芳香类同分异构体的结构简式: