可逆反应A(g) + 3B(g)  2C(g);△H < 0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件到下达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述错误的是( )
2C(g);△H < 0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件到下达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述错误的是( )
A.甲中A的转化率为75%
B.甲、乙中C的体积分数相同
C.平衡后再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向生成C的方向移动
D.乙中的热化学反应方程式为2C(g) A(g)+3B(g);△H=+3Q2 kJ·mol-1
A(g)+3B(g);△H=+3Q2 kJ·mol-1
溶度积常数表达式符合Ksp=·c(By-)的是( )
A.AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
B.Na2S 2Na++S2- 2Na++S2- |
C.Ag2S(s) 2Ag+(aq)+S2-(aq) 2Ag+(aq)+S2-(aq) |
D.PbI2(s) Pb2+(aq)+2I-(aq) Pb2+(aq)+2I-(aq) |
已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可作钡餐,BaCO3不能作钡餐的主要理由是( )
| A.BaSO4的溶度积常数比BaCO3的小 |
| B.S没有毒性,C有毒性 |
| C.BaSO4的密度大 |
| D.胃酸能与C结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 |
下列有关AgCl沉淀的溶解平衡的说法中,正确的是( )
| A.AgCl沉淀生成和溶解不断进行,但速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl的溶解度减小 |
| D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 |
25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )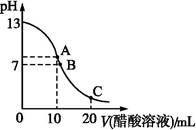
| A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-) |
| C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
已知0.1 mol·L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)