一定温度下(T1<T2),在三个体积均为2.0 L的恒容密闭容器中发生反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
| 容器编号 |
温度/℃ |
起始物质的量/mol |
平衡物质的量/mol |
|
| CO |
H2 |
CH3OH(g) |
||
| Ⅰ |
T1 |
0.2 |
0.4 |
0.18 |
| Ⅱ |
T1 |
0.4 |
0.8 |
|
| Ⅲ |
T2 |
0.2 |
0.4 |
0.16 |
下列说法正确的是
A.该反应的正反应为放热反应
B.达平衡时,容器Ⅰ中CH3OH(g)的体积分数比容器Ⅱ中的大
C.采取加压、增大c(H2)、加入合适的催化剂等措施,都能提高CO的转化率
D.若起始时向容器Ⅰ中充入CO 0.2 mol、H2 0.2 mol、CH3OH(g)0.5 mol,则反应将向正反应方向进行
下列四个数据都表示合成氨的反应速率,N2+3H2 2NH3,其中代表同一反应速率的
2NH3,其中代表同一反应速率的
是 ( )
①v(N2)=0.03 mol·L-1·min-1②v(NH3)=0.09 mol·L-1·min-1
③v(H2)=0.045 mol·L-1·min-1④v(H2)=0.135 mol·L-1·min-1
| A.①② | B.①③ | C.③④ | D.②④ |
下列叙述不正确的是()
| A.根据一次能源和二次能源的划分,氢气是二次能源 |
| B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源 |
| C.火电是将燃料中的化学能直接转化为电能的过程 |
| D.在火电过程中,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化 |
茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金,Pt、Fe合金网为电极材料的海水电池。有关这种电池的说法正确
的组合是 ( )
①铝合金是正极 ②铝合金是负极 ③海水是电解质溶液 ④铝合金电极发生还原反应
| A.②③ | B.②④ | C.①② | D.①④ |
下列电子式书写正确的是 ( )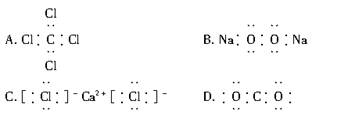
下列各物质的性质比较中,正确的是()
| A.氢化物沸点:HI>HBr>HCl>HF | B.原子半径:K>Cl>S |
| C.分子稳定性:HF>HCl>HBr>HI | D.单质熔点:Li<Na<K<Rb |