(15分) 已知①~④均为工业生产及应用的常见反应。其中常温下B、D、J、P气体,E为分子中原子个数比为1∶l的液体。A的相对分子质量为120。(个别反应的产物已略去)
试回答下列问题:
(1)反应F与N溶液反应的离子方程式为________________________________________;
(2)反应⑤中当有1mol电子转移时,氧化剂消耗 g。
(3)反应④的离子方程式为______________________________;
右图是该反应原理的示意图,该装置中使用的是 (填“阴”或“阳”)离子交换膜。图中从d处收集到的是 。
(4)工业上由D制取I的过程可表示为:
由D与B反应生成X的反应所用的设备是
①高炉 ②沸腾炉 ③接触室 ④分馏塔 ⑤吸收塔
已知400℃ 101Kpa时,2D(g) + B(g) 2X(g);△H =" –" 196.6KJ/mol,当2 mol D与1 mol B在该条件下反应达平衡时反应放热186.8 KJ。
2X(g);△H =" –" 196.6KJ/mol,当2 mol D与1 mol B在该条件下反应达平衡时反应放热186.8 KJ。
在实际生产中综合考虑各种因素,为提高D的转化率,工业选择了以下哪些条件______
①适当升高温度 ②增大压强 ③使用合适的催化剂 ④及时移走生成物 ⑤适当增大B的浓度 ⑥将反应物与生成物在热交换器中进行热交换
四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。
(1)W元素在周期表的位置为______________。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质与其它三种物质在一定条件下均能发生化学反应,该元素是_________(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为___________(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为_____________________________________。
(5)下列可作为比较Z和Mg金属性强弱的方法是_______(填代号)。
a.测两种元素单质的硬度和熔、沸点
b.测等浓度相应氯化物水溶液的pH
c.比较单质与同浓度盐酸反应的剧烈程度
d.比较两种元素在化合物中化合价的高低
(6)Z单质和Mg组成的混合物是一种常见的焰火材料,某化学兴趣小组设计了如下图所示的实验方案,测定该混合物中Z的质量分数。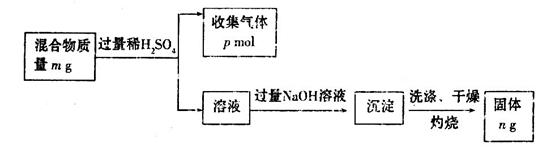
能确定混合物中Z的质量分数的数据组有_________(填代号)。
a. b.
b. c.
c.
白铁皮(镀锌铁皮)常用于制造屋面、卷管和各种容器,利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用是____________。
a.去除油污 b.溶解镀锌层 c.去除铁锈 d.钝化
(2)为获得Fe3O4胶体粒子,溶液B中必须含有一定量的Fe2+,可利用________检验其是否存在。
a.NaOH溶液 b.KSCN溶液 c.溶液KMnO4 d.氯水
(3)由溶液B制备Fe3O4胶体粒子的过程中,必须持续通入N2以保证产品的纯度,其原因是_____________ .
(4)在工业上常用水热法制造Fe3O4胶体粒子,有利于提高其纯度和磁性能,主要反应过程为:Fe2++S2O32-+O2+OH- Fe3O4(胶体)+S4O62-+H2O
Fe3O4(胶体)+S4O62-+H2O
①反应过程中起还原剂作用的微粒是________________;
②若反应过程中产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气在标准状况下的体积为____________L。
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下: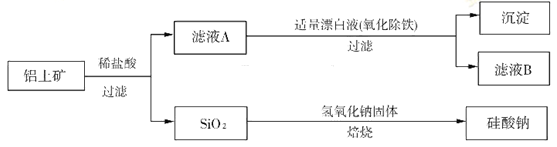
(1)滤液A所含溶质属于盐的是___________________。
(2)检验滤液B中是否还含有铁元素的方法为:_______________________________________
____________________________________________________________(注明试剂、现象)。
(3)将滤液B中的铝元素以沉淀形式析出,最佳试剂应选_____________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___________(填代号)。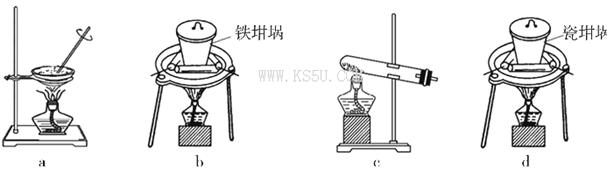
U、V、X、Y、Z五种短周期元素,原子序数依次增大。U、V两元素最高正价与最低负价之和均为0;Y与U同主族;X、Z分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(用实际元素符号表示)________________;
(2)由这五种元素中的几种组成的化合物A、B、C、D有如下转化关系: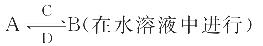
其中C是溶于水显酸性的气体;D是淡黄色固体。写出C与D反应的化学方程式:___________________;
①如果B为两性不溶物,则A的化学式为_________,A转化为B的离子方程式为:____________;
②如果B由四种元素组成且溶液显碱性,则B含有的化学键类型是_______,A所属物质类别为_ ___________(填选项序号)。a.酸 b.碱 c.盐 d.氧化物
氯及其化合物是中学化学中的重要研究对象之一。
(1)在实验室中常用二氧化锰和浓盐酸制取氯气,写出有关反应的离子方程式______________________;
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是______________________。向反应后的集气瓶中加入适量的蒸馏水,振荡,然后向所得溶液中滴加亚硫酸钠溶液,再滴加氯化钡溶液发现溶液变浑浊。写出上述反应的离子方程式:___________________ 、_____________________。