对可逆反应4NH3(g)+5O2(g) 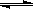 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 |
| C.达到化学平衡时,若减小压强,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是2v正(NH3)=3v正(H2O) |
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
t℃时,水的离子积为KW。在该温度下,混合可溶性的一元酸HA和一元碱BOH的溶液,下列有关混合液的各种关系中,可确认混合液呈中性的是
| A.pH="7" | B.c(OH-)= |
| C.c(A-) > c(B+) | D.c(H+)-c(OH-)=c(A-)-c(B+) |
下列化合物的核磁共振氢谱中出现三组峰的是
| A.2,2,3,3-四甲基丁烷 | B.2,3,4-三甲基戊烷 |
C.2,5-二甲基己烷 |
D.3,4-二甲基己烷 |
下列表示正确的是
A.CO2的比例模型: |
B.铝离子的结构示意图: |
C.CH4Si的结构式: |
D.甲基的电子式: |
下列有关实验的操作、现象和原理,正确的是
①吸滤操作可加快过滤速度,若吸滤完毕,则应先关闭水龙头,然后拆下连接抽气泵和吸滤瓶的橡皮管;②往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2;③重结晶时,溶液冷却速度越慢得到的晶体颗粒越大;④可用水鉴别已烷、四氯化碳、乙醇三种无色液体;⑤油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离;⑥加酶洗衣粉可用来洗涤棉织品、腈纶织品和涤纶织品;⑦硫酸亚铁铵晶体制备实验的最后一步是将溶液蒸发到有大量晶体析出,用余热蒸干即可得产物;⑧萃取时振荡的操作如图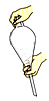
| A.②④⑧ | B.①③⑤ | C.③④⑥ | D.②④⑦ |