甲、乙两个容器内都在进行A→B的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则两容器中的反应速率
| A.甲快 | B.乙快 | C.相等 | D.无法确定 |
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是
| A.X单质不易与水反应 | B.XO2可被碳或氢还原为X |
C.XCl4的沸点比SiCl4的高 | D.XH4的稳定性比SiH4的高 |
在标准状况下,VL氨气溶于水配成1L密度为ρg/cm3的氨水,该氨水的物质的量浓度为
A. |
B. |
C.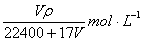 |
D.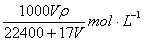 |
下列离子方程式书写正确的是
| A.NaNO2溶液中加入酸性KMnO4溶液:MnO4-+5NO2-+6H+=Mn2++5NO3-+3H2O |
| B.向硫酸氢钠溶液滴入少量氢氧化钡溶液:Ba2++2OH—+2H++SO42—=BaSO4↓+2H2O |
| C.在硫酸与硫酸铝的混合溶液中滴入极少量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓ |
| D.向FeI2溶液中滴入少量稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
某无色溶液中,若加入溴水,溴水褪色,若加入金属铝,铝溶解并产生大量氢气,则该溶液中可能大量存在的离子组是
| A.Na+、OH—、S 2—、ClO— | B.H+、Na+、Fe2+、NO3— |
C.K+、Ba2+、OH—、SO32— | D.Na+、K+、Ba2+、OH- |
将溶质的质量分数为a%、物质的量浓度为C1mol/L的稀硫酸加热蒸发掉一定量的水,使质量分数变为2a%,此时硫酸的物质的量浓度为C2mol/L,则C1和C2的数值关系
| A.C2=2C1 | B.C2<2C1 | C.C2>2C1 | D.C1=2C2 |