(14分)常温下,将某一元酸 和
和 溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的
溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的 如下表(设混合后溶液体积变化忽略不计):
如下表(设混合后溶液体积变化忽略不计):
| 实验编号 |
 物质的量浓度 物质的量浓度(  ) ) |
 物质的量浓度 物质的量浓度(  ) ) |
混合溶液的 |
| 甲 |
 |
 |
 |
| 乙 |
 |
 |
 |
| 丙 |
 |
 |
 |
| 丁 |
 |
 |
 |
请回答;
(1)仅依据甲组数据分析, 的取值范围为 。
的取值范围为 。
(2)从乙组情况分析, 是否一定等于
是否一定等于 (选填“是”或“否”)。若
(选填“是”或“否”)。若 为弱酸,计算出该混合溶液达平衡时
为弱酸,计算出该混合溶液达平衡时 电离常数
电离常数 的近似值是 (用含
的近似值是 (用含 代数式表示)。
代数式表示)。
(3)丙组混合溶液 的原因是 ,该组混合溶液中离子浓度的大小关系是 。
的原因是 ,该组混合溶液中离子浓度的大小关系是 。
(4)若把某离子水解的物质的量占某离子总物质的量的百分数叫做“水解度”,依据丁组数据,推知 在该条件下的水解度是 ,该溶液中,水电离出的
在该条件下的水解度是 ,该溶液中,水电离出的 是
是  。
。
采用32%~35%的FeCl3溶液腐蚀印刷线路板上的金属铜,腐蚀废液中主要含有CuCl2、FeCl2和HCl等溶质。
(1)用FeCl3溶液溶解印刷线路板上金属铜的化学方程式为。
(2)工业上用铁粉回收腐蚀废液中的铜,方法如下:
①用铁粉回收铜的操作为:加入过量铁粉,充分搅拌,过滤、洗涤、。
②科学家对铁置换铜的工艺有如下研究:
分别在a、b、c三种条件下回收腐蚀废液中的铜,取充分反应后的粉末各3.000 g分别放入甲、乙、丙三个烧杯中,再加入100 mL 0.5mol·L-1的硫酸,水浴加热(70 ℃),搅拌,进行除铁处理。分别在第10、20、30、40、50 min时,用吸管移取0.5 g左右的铜试样于试管内,测定铜粉中铁的含量(质量分数),其结果如下图所示。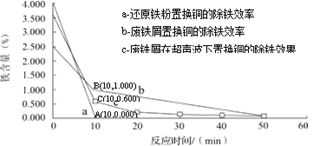
你认为除铁效果最好的是(填“a”、“b”或“c”),其原因是。
(3)工业上可用腐蚀废液制备CuCl2·2H2O,从而进行对废液的利用,其工艺流程如下: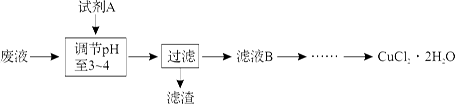
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀 |
2.3 |
7.5 |
4.7 |
| 完全沉淀 |
4.1 |
9.7 |
6.7 |
试剂A最好应选用(填写字母代号),理由是。
a.浓硫酸 b.Cl2c.NaClOd.NaOH溶液
氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2 + H2O H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。
(2)工业上常用熟石灰和氯气反应制取漂白粉,化学反应方程式是。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。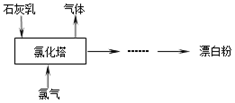
将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入。这样加料的目的是。处理从氯化塔中逸出气体的试剂为。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是,其原因可能是,
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
请回答下列问题:
(1)上述流程脱硫实现了(选填下列字母编号)。
A.废弃物的综合利用B.白色污染的减少 C.酸雨的减少
(2)过滤操作用到的玻璃仪器有:。
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是。
(4)写出KMnO4溶液加入到MnSO4溶液中制备MnO2的离子反应方程式:;用惰性电极电解MnSO4溶液也可制得MnO2,其阳极的电极反应式是。
(5)MnO2是碱性锌锰电池的电极材料,电池反应方程式为:2MnO2+Zn+H2O====2MnOOH+Zn(OH)2,写出该电池放电时,正极的电极反应式是。
为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示:
(1)用下图所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2),B中预 期的实验现象是。
(2)已知:C(s)+H2O(g)====CO(g)+H2(g) △H1=+131.3kJ•mol-1
C(s)+2H2O(g)====CO2(g)+2H2(g) △H2=+90kJ•mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K=。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图所示。该反应的ΔH________(填
“>”、“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
(4)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g)△H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是。
CH3OH(g)△H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是。
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如下:
已知:
①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)“调节pH=4”可选用的试剂是(填编号)。
①MgO②CuO ③MgCO3④Mg
(2)加入BaCl2的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是。
(3)“滤渣”的主要成分为。
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═===Mg(ClO3)2+2NaCl,再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为:①蒸发、浓缩、结晶;②;③;④过滤、洗涤、干燥。
(5)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是。
(6)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.00g产品配成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式:。
②产品中Mg(ClO3)2•6H2O的质量分数为。