卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的电子排布式为 ________。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为_________。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 。
(5)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 。
(6) ①HClO4、②HIO4、③H5IO6 [可写成(HO)5IO] 的酸性由强到弱的顺序为 (填序号) 。
(1)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是(填序号),写出反应⑥的化学方程式______。
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:i.反应A中, 4mol HCl被氧化,放出115.6 kJ的热量。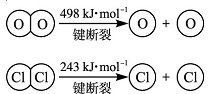 ①H2O的电子式为__________。
①H2O的电子式为__________。
②反应A中反应物的总能量_____________ 生成物的总能量。(填“大于、小于或等于”)
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键________(填“强”或“弱”)。
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)参照下图溶解度曲线,固体A是________(写化学式);固体B是________(写化学式);欲得到较纯的固体B需用少量的________(填“热水”或“冷水”)洗涤固体。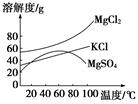
(2)操作⑤是实验室常用的过滤方法——减压过滤(俗称抽滤)。请问这种过滤方法其优点是____________________________________________________________。
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干个复分解反应,试写出其中任意一个反应的离子方程式________________________________________________________________________。
(2)加入凝聚剂可以除去其中的悬浮固体颗粒,该过程是________(填写下列各项的序号)。
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有化学过程又有物理过程
FeSO4·7H2O是常用的凝聚剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是________。
(3)通入二氧化碳的目的是________和________。
(4)气体A的作用是________。
(5)下列物质中,________可以作为气体A的代替品。(填写下列各项的序号)
①ClO2②浓氨水 ③SO2④浓硫酸
将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作。回答下列问题:
(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是________________________________________________________________________。
(2)向溶液中加入适量的________溶液,使氯化钾转化为沉淀。
(3)将混合液进行过滤,过滤装置和操作如图,指出图中的两处错误:
①________________________________________________________________________;
②________________________________________________________________________。
(4)为了从滤液中得到硝酸钾晶体,可选用的两种方法是:
①________________________________________________________________________;
②________________________________________________________________________。
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。他们采用了以下操作制备胶体,请将空白处填写完整。
(1)取一个烧杯,加入20 mL蒸馏水,加热至沸腾,然后向烧杯中滴加1 mL~2 mL饱和________溶液,继续煮沸,待__________________后,停止加热。
(2)将制得的胶体放入半透膜制成的袋内,如图所示。放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察________(填“有”或“无”)丁达尔现象;再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为____________。
(3)将半透膜内的液体倒入U形管中,如图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是____________(填“阴”或“阳”)极附近颜色逐渐变深,其原因是__________________________________。