X、Y、M、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)基态Y原子的价电子排布图是______;Z所在周期中第一电离能最大的主族元素是_______(元素名称)
(2)XY2¯离子的立体构型是________;R2+的水合离子[R(H2O)4]2+中,提供孤电子对的原子是________(元素符号)。
(3) 已知XH3易与R2+形成配离子,但XM3不易与R2+形成配离子,其原因是_______________
(4)Y与R所形成的化合物晶体晶胞如右图所示,该晶体的化学式:_____________;晶胞参数如图所示,则该晶胞密度是_______________g·cm-3(列式并计算结果,保留小数点儿后一位)。
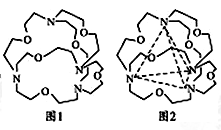
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是________(填标号)。
| A.CF4 | B.CH4 | C.NH4+ | D.H2O |
某工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,现设计如下综合利用的主要流程。试推断:
(1)方框内物质A和B的化学式:A;B;
(2)第③步通入B的离子方程式为 ___。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3 e -= NO+2H2O
KMnO4、Na2CO3、FeO、Al(OH)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出该氧化还原反应的方程式(不需配平):
______________________________________________________;
(2)反应中,氧化剂是_________,被氧化的元素是_____________;
(3)如反应转移了0.6mol e-,则产生的气体在标准状况下体积为___ L。
人类生活离不开化学,硫酸亚铁、醋酸、小苏打、食盐、次氯酸钙、氢氧化铝都是生活中较常见的化学物质。
(1)医疗上常用_____________(从上述物质中选,填化学式)糖衣片治疗贫血病,外面包裹糖衣的目的是;
(2)治疗胃酸过多的药物主要成分是氢氧化铝或碳酸氢钠,请分别写出中和胃酸的离子方程式:____________________、 ___________________________;
(3)生活中的食醋和淀粉溶液分别属于分散系中的溶液和,用可以鉴别(填化学专用名词)。
肉桂酸是重要的有机合成中间体,广泛用于医药、香料、塑料和感光树脂等化工产品中。肉桂酸的结构简式为右图,请回答下列问题。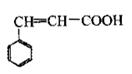
(1)肉桂酸的分子式是。
(2)写出肉桂酸的顺式结构。
(3)肉桂酸与乙醇在一定条件下发生酯化反应的化学方程式是。
(4)已知: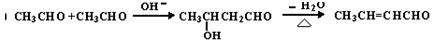
由苯甲醛制备肉桂酸的合成路线如下: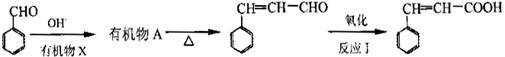
①上述合成路线中,反应I中氧化剂可选择(填写正确选项的字母)。
a.高锰酸钾酸性溶液 b.新制氧氧化铜 c.溴的四氯化碳溶液
②苯甲醛与有机物X反应生成A的化学方程式是
某有机物A由C、H、O三种元素组成,在一定条件下,A、B、C、D、E之间的转化关系如下: 170℃ O2,催化剂氧化
170℃ O2,催化剂氧化
|
浓硫酸