Ⅰ.工业上可用煤制天然气,生产过程中有多种途径生成CH4。写出CO2与H2反应生成 CH4和H2O的热化学方程式 。
已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
Ⅱ.电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: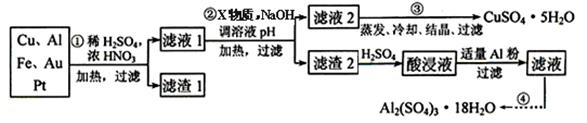
按要求回答下列问题:
(1)滤渣1中存在的金属有____________。
(2)已知沉淀物的pH如下表:
| |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
| Fe2+ |
7.0 |
9.0 |
| Fe3+ |
1.9 |
3.7 |
| Cu2+ |
4.9 |
6.7 |
| Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:________________
(4)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在 (填仪器名称)中加热脱水。
(5)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
该电池放电时负极反应式为 ,每有1mol K2FeO4被还原,转移电子的物质的量为 ,充电时阳极反应式为 。
某学生设计了三个实验方案,用以检验淀粉的水解情况。
方案甲:淀粉液 水解液
水解液 中和液
中和液 溶液变蓝。
溶液变蓝。
结论:淀粉完全没有水解。
方案乙:淀粉液 水解液
水解液 无银镜现象。
无银镜现象。
结论:淀粉完全没有水解。
方案丙:淀粉液 水解液
水解液 中和液
中和液 有银镜现象。
有银镜现象。
结论:淀粉已经水解。
根据上述操作、现象,首先回答结论是否正确,然后简要说明理由:
(a)方案甲________
(b)方案乙________
(c)方案丙________。
在NaOH溶液中加入几滴CuSO4溶液,可以观察到的现象是,发生反应的离子方程式是;在其中加入乙醛溶液并,可观察到的现象是,反应的化学方程式为。此反应也可用于检验。
在一支洁净的试管中加入少量的AgNO3溶液,然后,滴加稀氨水,直到生成的沉淀刚好溶解为止,得到的无色溶液称为溶液。在此溶液中滴加几滴乙醛溶液,经,可观察到的现象是此反应可以用来检验的存在。反应的化学方程式为
。
取9.20g只含羟基,不含其它官能团的饱和多元醇,置于足量的氧气中,经点燃,醇完全燃烧,燃烧后的气体经过浓硫酸时,浓硫酸增重7.20g,剩余气体经CaO吸收后,体积减少6.72L(标准状况下测定)。
(1)9.20g醇中C、H、O的物质的量分别为:Cmol、Hmol、Omol;该醇中C、H、O的原子个数之比为。
(2)由以上比值能否确定该醇的分子式;其原因是。
(3)这种多元醇是无色、粘稠、有甜味的液体,易溶解于水和乙醇,是重要的化工原料,可以由于制备、配制化妆品,试写出该饱和多元醇的结构简式,其俗名是。
图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器。当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生。此时水浴加热,发生化学反应。过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出。试回答:
(1)B逸出的主要气体名称__________;(2)D瓶的作用是___________________;
(3)E管的作用是___________;(4)F管口点燃的气体分子式__________________。
(5)A瓶中无水硫酸铜粉末变蓝的原因是_______;(6)A中发生的方程式:。